
PENTAGLOBIN 50 mg/ml oldatos infúzió
PENTAGLOBIN 50 mg/ml oldatos infúzió betegtájékoztatója
1. Milyen típusú gyógyszer a Pentaglobin és milyen betegségek esetén alkalmazható?
A Pentaglobin emberi vérből előállított gyógyszer, amely ellenanyagokat tartalmaz (az ellenanyagok a szervezet immunrendszerének alkotóelemei). Ez a gyógyszer oldatos infúzió formájában áll rendelkezésre, amelyet egy vénába kell beadni, infúzió formájában.
A Pentaglobin a következő esetekben alkalmazható
- súlyos bakteriális fertőzések kiegészítő kezelésére, egyidejű antibiotikum kezelés kiegészítéseként.
- hiányzó antitestek (immunglobulinok) pótlására súlyos szerzett immunhiányos betegek esetén.
2. Tudnivalók a Pentaglobin alkalmazása előtt
Ne alkalmazza a Pentaglobin-t
- ha allergiás a humán immunglobulinra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére;
- ha immunglobulin A hiányban szenved, különösen akkor, ha a vérében immunglobulin A ellenes antitestek is jelen vannak, mert ez anafilaxiához vezethet.
Figyelmeztetések és óvintézkedések
A Pentaglobin alkalmazása előtt beszéljen kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel,
- ha első alkalommal vagy hosszú szünet után kap humán immunglobulint, vagy ha más immunglobulin készítményről váltottak Önnél erre a készítményre. Kezelőorvosa ilyen esetekben gondosan ellenőrizni fogja Önt.
- ha aktív (fennálló) fertőzése vagy a háttérben meghúzódó krónikus gyulladása van.
- ha allergiás az immunglobulinokra (lásd a "Ne alkalmazza a Pentaglobin-t" című pontot).
- ha Ön
-- erősen túlsúlyos vagy idős;
-- magas vérnyomása (hipertónia), cukorbetegsége vagy érbetegsége van;
-- fokozott hajlama van vérrögök kialakulására;
-- huzamosabb ideig ágyhoz kötött;
-- alacsony a vértérfogata (hipovolémia), vagy sűrűbb a vére;
-- eleve vesebeteg; vagy olyan gyógyszereket alkalmaz, amelyek károsan befolyásolhatják a veseműködést.
Ilyen esetekben fokozott lehet a mellékhatások előfordulása. Kezelőorvosa ilyen esetekben le fogja állítani a Pentaglobin kezelést, vagy más óvintézkedésekről fog gondoskodni (pl. rendkívül lassú sebességgel fogja beadni az infúziót).
Előfordulhat, hogy Ön allergiás az immunglobulinokkal szemben anélkül, hogy tudna erről, és ez még akkor is előfordulhat, ha az immunglobulinokkal végzett korábbi kezelést jól viselte. Valódi túlérzékenységi reakciók mindenesetre ritkán fordulnak elő. Bizonyos mellékhatások (pl. fejfájás, rohamokban jelentkező kipirulás, hidegrázás, izomfájdalom, zihálás, szapora szívverés (tahikardia), deréktáji fájdalom, hányinger és alacsony vérnyomás (hipotenzió) az infúzió sebességével függhetnek össze. Azonnal tájékoztassa kezelőorvosát, ha a Pentaglobin beadása alatt ilyen reakciókat észlel. Kezelőorvosa eldönti, hogy szükséges-e az infúzió sebességének csökkentése vagy az infúzió leállítása, és gondoskodik a szükséges orvosi ellátásról.
A fertőzésekkel kapcsolatos biztonsági információk
A Pentaglobin emberi vérplazmából (a vér folyékony része) készül. Emberi vérből vagy plazmából készült gyógyszerek esetében mindent megtesznek annak megelőzésére, hogy a gyógyszer beadásával fertőző kórokozókat vigyenek át a betegekbe. Minden véradót megvizsgálnak a vírusok és a fertőző betegségek szempontjából. Emellett a gyógyszer megfelelő vírus inaktiválási vagy eltávolítási eljárásban részesül.
Ezen óvintézkedések ellenére az emberi vérből vagy plazmából előállított gyógyszerek beadásakor nem zárható ki teljes mértékben a fertőzések átvitelének kockázata.
Az alkalmazott intézkedések hatékonynak tekinthetők a burokkal rendelkező vírusok, mint például
- az emberi immunhiány vírus (HIV),
- a hepatitisz B vírus (HBV),
- a hepatitisz C vírus (HCV) ellen.
Az alkalmazott intézkedések kevésbé lehetnek hatásosak burok nélküli vírusok, például
- hepatitisz A vírus (HAV),
- parvovírus B19 esetén.
Az immunglobulinok alkalmazását mindeddig nem hozták összefüggésbe hepatitisz A vagy parvovírus B19 fertőzéssel, vélhetően azért, mert a Pentaglobin-ban található antitestek e fertőzésekkel szemben is védelmet nyújtanak.
Kifejezetten ajánlott, hogy kezelőorvosa a Pentaglobin adag beadásakor minden alkalommal feljegyezze a gyógyszer nevét és a gyártási tétel számát. A gyártási szám felvilágosítást nyújt az adott esetben alkalmazott gyógyszer kiindulási anyagairól. Ily módon, szükség esetén összefüggésbe hozható az Ön esete az alkalmazott kiindulási anyagokkal.
Gyermekek és serdülők
Újszülötteknél és csecsemőknél az infúziós reakciók, a túlérzékenységi vagy allergiás reakciók tünetei különbözhetnek más korcsoportba tartozóknál tapasztaltaktól, lásd "Lehetséges mellékhatások" című pontot.
Egyéb gyógyszerek és a Pentaglobin
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
A Pentaglobin csökkentheti bizonyos oltóanyagok hatékonyságát, például csökkenhet az alábbi fertőzések elleni oltóanyagok hatékonysága:
- kanyaró;
- rózsahimlő (rubeola);
- mumpsz;
- bárányhimlő (varicella).
A Pentaglobin alkalmazása után az oltással 3 hónapot kell várni; kanyaró elleni védőoltás esetén ez a várakozási idő akár 1 év is lehet.
A Pentaglobin és kacsdiuretikumok (más néven vízhajtók) együttadása kerülendő.
Terhesség és szoptatás
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
Kezelőorvosa fogja eldönteni, hogy kaphat-e Pentaglobin kezelést a terhesség vagy szoptatás alatt.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Pentaglobin kismértékben befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket. Ha Önnél mellékhatások lépnek fel a kezelés során, meg kell várnia, amíg azok elmúlnak, mielőtt gépjárművet vezetne vagy gépeket kezelne.
A Pentaglobin glükózt és nátriumot tartalmaz
1 ml oldatos infúzió 25 mg glükózt tartalmaz (megfelel kb. 0,0021 szénhidrát egységnek). A (70 kg testtömegű) felnőttek megközelítőleg 350 ml-es napi adagja 8,75 g glükózt tartalmaz, ami körülbelül 0,735 szénhidrát egységnek felel meg. Ezt figyelembe kell venni, amennyiben Önnek cukorbeteg diétát kell tartania.
A Pentaglobin 0,078 mmol/ml (1,79 mg/ml) nátriumot (a konyhasó fő összetevője) tartalmaz. A (70 kg testtömegű) felnőttek körülbelül 350 ml-es napi adagja 27,3 mmol (627,6 mg) nátriumot tartalmaz, ami megfelel a WHO által ajánlott maximális napi 2 g nátriumbevitel kb. 31%-ának felnőtteknél.
3. Hogyan kell alkalmazni a Pentaglobin-t?
A Pentaglobin-t kezelőorvosa fogja beadni Önnek. Az adagolás az Ön immunállapotától és a betegség súlyosságától függ.
Az ajánlott adagolás:
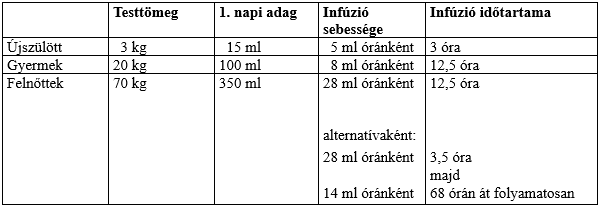
Újszülöttek és csecsemők
5 ml (0,25 g) testtömeg-kilogrammonként naponta, három egymást követő napon. A klinikai lefolyástól függően ismételt alkalmazás lehet szükséges.
Gyermekek és felnőttek
Súlyos bakteriális fertőzések kezelése esetén: 5 ml (0,25 g) testtömeg-kilogrammonként naponta, három egymást követő napon. A klinikai lefolyástól függően ismételt alkalmazás lehet szükséges.
Hiányzó antitestek (immunglobulinok) pótlására olyan betegeknél, akiknek az immunrendszere valamilyen gyógyszer vagy besugárzás következtében meggyengült, illetve súlyos szerzett immungyengeség esetén: 3-5 ml (0,15-0,25 g) testtömeg-kilogrammonként. Szükség esetén hetente ismételhető.
A készítményt vénába (intravénás infúzió formájában) kell beadni a következő infúziós sebességek alkalmazásával:
Újszülöttek és csecsemők:
Óránként és testtömeg-kilogrammonként 1,7 ml, infúziós pumpával.
Gyermekek és felnőttek:
Óránként és testtömeg-kilogrammonként 0,4 ml,
vagy:
az első 100 ml: óránként és testtömeg-kilogrammonként 0,4 ml, majd folyamatosan adagolva óránként és testtömeg-kilogrammonként 0,2 ml, addig, amíg 72 órán belül a testtömeg-kilogrammonkénti 15,0 ml összadagot el nem érik.
Példák:
Májkárosodás
Nincs rendelkezésre álló bizonyíték arra vonatkozólag, hogy dózismódosításra lenne szükség.
Vesekárosodás
A dózismódosítás csak klinikailag indokolt esetben szükséges, lásd "Figyelmeztetések és óvintézkedések" című pontot.
Idősek
Nem szükséges a dózismódosítás, hacsak klinikailag nem indokolt.
Az alkalmazás módja
A Pentaglobin intravénás infúzióként (vénába adott infúzió) alkalmazható.
A gyógyszert alkalmazás előtt szoba- vagy testhőmérsékletre kell melegíteni.
Ha az előírtnál több Pentaglobin-t alkalmazott
A nagy mennyiségben adott Pentaglobin folyadék-túlterheléshez és a vér besűrűsödéséhez (hiperviszkozitásához) vezethet, különösen, ha veszélyeztetett - köztük gyermekeknél, valamint idős és károsodott szív- és veseműködésű - betegeknél alkalmazzák. Ha úgy gondolja, hogy az előírtnál több Pentaglobin-t kapott, mihamarabb beszéljen erről kezelőorvosával.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A Pentaglobin-nal végzett klinikai vizsgálatok során a következő mellékhatásokat jelentették:
Gyakori (10 kezelt beteg közül legfeljebb 1-et érinthet):
- alacsony vérnyomás
- hányinger, hányás
- fokozott verejtékezés (hiperhidrózis)
Nem gyakori (100 kezelt beteg közül legfeljebb 1-et érinthet):
- allergiás reakciók
- bőrreakciók/allergiás dermatitisz
- hátfájdalom
A következő mellékhatásokat a Pentaglobin forgalomba hozatalát követő vizsgálatok során jelentették:
Nem ismert (a gyakoriság a rendelkezésre álló adatokból nem állapítható meg)
- agyhártyagyulladás (aszeptikus meningitisz)
- vérszegénység (hemolitikus anémia) / vörösvértestek szétesése (hemolízis)
- anafilaxiás sokk, anafilaktoid reakciók, túlérzékenységi reakciók
- fejfájás, szédülés
- szapora szívverés (tahikardia)
- bőr vörösödése (rohamokban jelentkező kipirulás)
- légszomj (diszpnoé)
- viszketés (pruritusz)
- akut veseelégtelenség és/vagy csökkent veseműködést jelző vérvizsgálati eredmények (a szérumkreatinin-szint megemelkedése)
- hidegrázás, láz
Gyermekek és serdülők:
Habár az újszülötteknél és csecsemőknél a mellékhatások általában hasonlóak, mint más korcsoportokban tapasztalhatóak (pl. infúziós reakciók, anafilaxiás reakciók, túlérzékenység), a tüneteiket és jeleiket tekintve különböznek. Például szívritmuszavar (szapora vagy lassú szívverés), szapora légzésszám, csökkent oxigénszaturáció, bőrszín elváltozása (beleértve a sápadtságot és/vagy kékes elszíneződést), és csökkent izomtónus alkalmanként előfordulhatnak.
A humán immunglobulin készítmények általában a következő mellékhatásokat okozhatják:
- hidegrázás, fejfájás, szédülés, láz, hányás, allergiás reakciók, hányinger, ízületi fájdalom, alacsony vérnyomás és középsúlyos deréktáji fájdalom
- az erekben lévő vörösvértestek szétesése miatt bekövetkező vörösvértestszám-csökkenés ((reverzibilis) hemolitikus reakciók) és (ritkán) transzfúziót igénylő hemolitikus anémia
- (ritkán) hirtelen vérnyomásesés, vagy kivételes esetekben anafilaxiás sokk
- (ritkán) átmeneti bőrreakciók (beleértve a kután lupusz eritematózuszt - ismeretlen gyakorisággal)
- (nagyon ritkán) tromboembóliás reakciók, mint pl. szívroham (miokardiális infarktus), sztrók, a tüdő véredényeiben kialakuló vérrögök (tüdőembólia), vérrögök kialakulása a vénában (mélyvénás trombózis)
- az agyat és a gerincvelőt védő burok, illetve hártya átmeneti akut gyulladásának esetei (reverzibilis aszeptikus meningitisz)
- károsodott veseműködésre utaló vérvizsgálati eredmények és/vagy hirtelen kialakuló veseelégtelenség
- transzfúzióval összefüggő akut tüdőkárosodás (TRALI) esetei. Ez nem szív eredetű folyadékfelgyülemlést okoz a tüdő levegővel teli tereiben (nem-kardiogén pulmonális ödéma) a következő tünetekkel: súlyos nehézlégzés (respiratórikus distressz), szapora légvétel (tahipnoé), rendellenesen alacsony oxigénszint a vérben (hipoxia) és megnövekedett testhőmérséklet (láz).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik.
A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül:
Nemzeti Népegészségügyi és Gyógyszerészeti Központ, Postafiók 450, H-1372 Budapest
honlap: www.ogyei.gov.hu
elektronikus bejelentő form: https://mellekhatas.ogyei.gov.hu/
e-mail: adr.box@ogyei.gov.hu
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Pentaglobin-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon (az EXP után) feltüntetett lejárati idő után ne alkalmazza ezt a gyógyszert.
Hűtőszekrényben (2 °C - 8 °C) tárolandó. Nem fagyasztható! A fénytől való védelem érdekében az eredeti csomagolásában tárolandó.
Alkalmazása előtt a készítményt szemügyre kell venni. Az oldatnak tisztának, vagy enyhén-közepesen opalizálónak (tejszerű fényűnek) kell lennie. A Pentaglobin nem használható fel, ha az oldat zavaros vagy üledéket tartalmaz.
Az oldatot az injekciós üveg felbontása után azonnal fel kell használni! A fel nem használt felbontott készítményt meg kell semmisíteni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Pentaglobin?
- A készítmény hatóanyaga: humán immunglobulin;
1 ml oldat 50 mg humán plazmafehérjét tartalmaz, amelynek legalább 95%-a immunglobulin: 6 mg IgM, 6 mg IgA, 38 mg IgG.
- Egyéb összetevők: glükóz-monohidrát (Ph. Eur.), nátrium-klorid, injekcióhoz való víz.
Milyen a Pentaglobin külleme és mit tartalmaz a csomagolás?
A Pentaglobin kis vagy közepes mértékben opálos, színtelen vagy halványsárga oldat színtelen üvegből készült injekciós üvegben.
A Pentaglobin a következő kiszerelésekben kapható:
Egy darab, 10 ml (0,5 g), 50 ml (2,5 g) vagy 100 ml (5,0 g) oldatot tartalmazó injekciós üveg.
A Pentaglobin emberi vérből előállított gyógyszer, amely ellenanyagokat tartalmaz (az ellenanyagok a szervezet immunrendszerének alkotóelemei). Ez a gyógyszer oldatos infúzió formájában áll rendelkezésre, amelyet egy vénába kell beadni, infúzió formájában.
A Pentaglobin a következő esetekben alkalmazható
- súlyos bakteriális fertőzések kiegészítő kezelésére, egyidejű antibiotikum kezelés kiegészítéseként.
- hiányzó antitestek (immunglobulinok) pótlására súlyos szerzett immunhiányos betegek esetén.
2. Tudnivalók a Pentaglobin alkalmazása előtt
Ne alkalmazza a Pentaglobin-t
- ha allergiás a humán immunglobulinra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére;
- ha immunglobulin A hiányban szenved, különösen akkor, ha a vérében immunglobulin A ellenes antitestek is jelen vannak, mert ez anafilaxiához vezethet.
Figyelmeztetések és óvintézkedések
A Pentaglobin alkalmazása előtt beszéljen kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel,
- ha első alkalommal vagy hosszú szünet után kap humán immunglobulint, vagy ha más immunglobulin készítményről váltottak Önnél erre a készítményre. Kezelőorvosa ilyen esetekben gondosan ellenőrizni fogja Önt.
- ha aktív (fennálló) fertőzése vagy a háttérben meghúzódó krónikus gyulladása van.
- ha allergiás az immunglobulinokra (lásd a "Ne alkalmazza a Pentaglobin-t" című pontot).
- ha Ön
-- erősen túlsúlyos vagy idős;
-- magas vérnyomása (hipertónia), cukorbetegsége vagy érbetegsége van;
-- fokozott hajlama van vérrögök kialakulására;
-- huzamosabb ideig ágyhoz kötött;
-- alacsony a vértérfogata (hipovolémia), vagy sűrűbb a vére;
-- eleve vesebeteg; vagy olyan gyógyszereket alkalmaz, amelyek károsan befolyásolhatják a veseműködést.
Ilyen esetekben fokozott lehet a mellékhatások előfordulása. Kezelőorvosa ilyen esetekben le fogja állítani a Pentaglobin kezelést, vagy más óvintézkedésekről fog gondoskodni (pl. rendkívül lassú sebességgel fogja beadni az infúziót).
Előfordulhat, hogy Ön allergiás az immunglobulinokkal szemben anélkül, hogy tudna erről, és ez még akkor is előfordulhat, ha az immunglobulinokkal végzett korábbi kezelést jól viselte. Valódi túlérzékenységi reakciók mindenesetre ritkán fordulnak elő. Bizonyos mellékhatások (pl. fejfájás, rohamokban jelentkező kipirulás, hidegrázás, izomfájdalom, zihálás, szapora szívverés (tahikardia), deréktáji fájdalom, hányinger és alacsony vérnyomás (hipotenzió) az infúzió sebességével függhetnek össze. Azonnal tájékoztassa kezelőorvosát, ha a Pentaglobin beadása alatt ilyen reakciókat észlel. Kezelőorvosa eldönti, hogy szükséges-e az infúzió sebességének csökkentése vagy az infúzió leállítása, és gondoskodik a szükséges orvosi ellátásról.
A fertőzésekkel kapcsolatos biztonsági információk
A Pentaglobin emberi vérplazmából (a vér folyékony része) készül. Emberi vérből vagy plazmából készült gyógyszerek esetében mindent megtesznek annak megelőzésére, hogy a gyógyszer beadásával fertőző kórokozókat vigyenek át a betegekbe. Minden véradót megvizsgálnak a vírusok és a fertőző betegségek szempontjából. Emellett a gyógyszer megfelelő vírus inaktiválási vagy eltávolítási eljárásban részesül.
Ezen óvintézkedések ellenére az emberi vérből vagy plazmából előállított gyógyszerek beadásakor nem zárható ki teljes mértékben a fertőzések átvitelének kockázata.
Az alkalmazott intézkedések hatékonynak tekinthetők a burokkal rendelkező vírusok, mint például
- az emberi immunhiány vírus (HIV),
- a hepatitisz B vírus (HBV),
- a hepatitisz C vírus (HCV) ellen.
Az alkalmazott intézkedések kevésbé lehetnek hatásosak burok nélküli vírusok, például
- hepatitisz A vírus (HAV),
- parvovírus B19 esetén.
Az immunglobulinok alkalmazását mindeddig nem hozták összefüggésbe hepatitisz A vagy parvovírus B19 fertőzéssel, vélhetően azért, mert a Pentaglobin-ban található antitestek e fertőzésekkel szemben is védelmet nyújtanak.
Kifejezetten ajánlott, hogy kezelőorvosa a Pentaglobin adag beadásakor minden alkalommal feljegyezze a gyógyszer nevét és a gyártási tétel számát. A gyártási szám felvilágosítást nyújt az adott esetben alkalmazott gyógyszer kiindulási anyagairól. Ily módon, szükség esetén összefüggésbe hozható az Ön esete az alkalmazott kiindulási anyagokkal.
Gyermekek és serdülők
Újszülötteknél és csecsemőknél az infúziós reakciók, a túlérzékenységi vagy allergiás reakciók tünetei különbözhetnek más korcsoportba tartozóknál tapasztaltaktól, lásd "Lehetséges mellékhatások" című pontot.
Egyéb gyógyszerek és a Pentaglobin
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
A Pentaglobin csökkentheti bizonyos oltóanyagok hatékonyságát, például csökkenhet az alábbi fertőzések elleni oltóanyagok hatékonysága:
- kanyaró;
- rózsahimlő (rubeola);
- mumpsz;
- bárányhimlő (varicella).
A Pentaglobin alkalmazása után az oltással 3 hónapot kell várni; kanyaró elleni védőoltás esetén ez a várakozási idő akár 1 év is lehet.
A Pentaglobin és kacsdiuretikumok (más néven vízhajtók) együttadása kerülendő.
Terhesség és szoptatás
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
Kezelőorvosa fogja eldönteni, hogy kaphat-e Pentaglobin kezelést a terhesség vagy szoptatás alatt.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Pentaglobin kismértékben befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket. Ha Önnél mellékhatások lépnek fel a kezelés során, meg kell várnia, amíg azok elmúlnak, mielőtt gépjárművet vezetne vagy gépeket kezelne.
A Pentaglobin glükózt és nátriumot tartalmaz
1 ml oldatos infúzió 25 mg glükózt tartalmaz (megfelel kb. 0,0021 szénhidrát egységnek). A (70 kg testtömegű) felnőttek megközelítőleg 350 ml-es napi adagja 8,75 g glükózt tartalmaz, ami körülbelül 0,735 szénhidrát egységnek felel meg. Ezt figyelembe kell venni, amennyiben Önnek cukorbeteg diétát kell tartania.
A Pentaglobin 0,078 mmol/ml (1,79 mg/ml) nátriumot (a konyhasó fő összetevője) tartalmaz. A (70 kg testtömegű) felnőttek körülbelül 350 ml-es napi adagja 27,3 mmol (627,6 mg) nátriumot tartalmaz, ami megfelel a WHO által ajánlott maximális napi 2 g nátriumbevitel kb. 31%-ának felnőtteknél.
3. Hogyan kell alkalmazni a Pentaglobin-t?
A Pentaglobin-t kezelőorvosa fogja beadni Önnek. Az adagolás az Ön immunállapotától és a betegség súlyosságától függ.
Az ajánlott adagolás:
Újszülöttek és csecsemők
5 ml (0,25 g) testtömeg-kilogrammonként naponta, három egymást követő napon. A klinikai lefolyástól függően ismételt alkalmazás lehet szükséges.
Gyermekek és felnőttek
Súlyos bakteriális fertőzések kezelése esetén: 5 ml (0,25 g) testtömeg-kilogrammonként naponta, három egymást követő napon. A klinikai lefolyástól függően ismételt alkalmazás lehet szükséges.
Hiányzó antitestek (immunglobulinok) pótlására olyan betegeknél, akiknek az immunrendszere valamilyen gyógyszer vagy besugárzás következtében meggyengült, illetve súlyos szerzett immungyengeség esetén: 3-5 ml (0,15-0,25 g) testtömeg-kilogrammonként. Szükség esetén hetente ismételhető.
A készítményt vénába (intravénás infúzió formájában) kell beadni a következő infúziós sebességek alkalmazásával:
Újszülöttek és csecsemők:
Óránként és testtömeg-kilogrammonként 1,7 ml, infúziós pumpával.
Gyermekek és felnőttek:
Óránként és testtömeg-kilogrammonként 0,4 ml,
vagy:
az első 100 ml: óránként és testtömeg-kilogrammonként 0,4 ml, majd folyamatosan adagolva óránként és testtömeg-kilogrammonként 0,2 ml, addig, amíg 72 órán belül a testtömeg-kilogrammonkénti 15,0 ml összadagot el nem érik.
Példák:

Májkárosodás
Nincs rendelkezésre álló bizonyíték arra vonatkozólag, hogy dózismódosításra lenne szükség.
Vesekárosodás
A dózismódosítás csak klinikailag indokolt esetben szükséges, lásd "Figyelmeztetések és óvintézkedések" című pontot.
Idősek
Nem szükséges a dózismódosítás, hacsak klinikailag nem indokolt.
Az alkalmazás módja
A Pentaglobin intravénás infúzióként (vénába adott infúzió) alkalmazható.
A gyógyszert alkalmazás előtt szoba- vagy testhőmérsékletre kell melegíteni.
Ha az előírtnál több Pentaglobin-t alkalmazott
A nagy mennyiségben adott Pentaglobin folyadék-túlterheléshez és a vér besűrűsödéséhez (hiperviszkozitásához) vezethet, különösen, ha veszélyeztetett - köztük gyermekeknél, valamint idős és károsodott szív- és veseműködésű - betegeknél alkalmazzák. Ha úgy gondolja, hogy az előírtnál több Pentaglobin-t kapott, mihamarabb beszéljen erről kezelőorvosával.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A Pentaglobin-nal végzett klinikai vizsgálatok során a következő mellékhatásokat jelentették:
Gyakori (10 kezelt beteg közül legfeljebb 1-et érinthet):
- alacsony vérnyomás
- hányinger, hányás
- fokozott verejtékezés (hiperhidrózis)
Nem gyakori (100 kezelt beteg közül legfeljebb 1-et érinthet):
- allergiás reakciók
- bőrreakciók/allergiás dermatitisz
- hátfájdalom
A következő mellékhatásokat a Pentaglobin forgalomba hozatalát követő vizsgálatok során jelentették:
Nem ismert (a gyakoriság a rendelkezésre álló adatokból nem állapítható meg)
- agyhártyagyulladás (aszeptikus meningitisz)
- vérszegénység (hemolitikus anémia) / vörösvértestek szétesése (hemolízis)
- anafilaxiás sokk, anafilaktoid reakciók, túlérzékenységi reakciók
- fejfájás, szédülés
- szapora szívverés (tahikardia)
- bőr vörösödése (rohamokban jelentkező kipirulás)
- légszomj (diszpnoé)
- viszketés (pruritusz)
- akut veseelégtelenség és/vagy csökkent veseműködést jelző vérvizsgálati eredmények (a szérumkreatinin-szint megemelkedése)
- hidegrázás, láz
Gyermekek és serdülők:
Habár az újszülötteknél és csecsemőknél a mellékhatások általában hasonlóak, mint más korcsoportokban tapasztalhatóak (pl. infúziós reakciók, anafilaxiás reakciók, túlérzékenység), a tüneteiket és jeleiket tekintve különböznek. Például szívritmuszavar (szapora vagy lassú szívverés), szapora légzésszám, csökkent oxigénszaturáció, bőrszín elváltozása (beleértve a sápadtságot és/vagy kékes elszíneződést), és csökkent izomtónus alkalmanként előfordulhatnak.
A humán immunglobulin készítmények általában a következő mellékhatásokat okozhatják:
- hidegrázás, fejfájás, szédülés, láz, hányás, allergiás reakciók, hányinger, ízületi fájdalom, alacsony vérnyomás és középsúlyos deréktáji fájdalom
- az erekben lévő vörösvértestek szétesése miatt bekövetkező vörösvértestszám-csökkenés ((reverzibilis) hemolitikus reakciók) és (ritkán) transzfúziót igénylő hemolitikus anémia
- (ritkán) hirtelen vérnyomásesés, vagy kivételes esetekben anafilaxiás sokk
- (ritkán) átmeneti bőrreakciók (beleértve a kután lupusz eritematózuszt - ismeretlen gyakorisággal)
- (nagyon ritkán) tromboembóliás reakciók, mint pl. szívroham (miokardiális infarktus), sztrók, a tüdő véredényeiben kialakuló vérrögök (tüdőembólia), vérrögök kialakulása a vénában (mélyvénás trombózis)
- az agyat és a gerincvelőt védő burok, illetve hártya átmeneti akut gyulladásának esetei (reverzibilis aszeptikus meningitisz)
- károsodott veseműködésre utaló vérvizsgálati eredmények és/vagy hirtelen kialakuló veseelégtelenség
- transzfúzióval összefüggő akut tüdőkárosodás (TRALI) esetei. Ez nem szív eredetű folyadékfelgyülemlést okoz a tüdő levegővel teli tereiben (nem-kardiogén pulmonális ödéma) a következő tünetekkel: súlyos nehézlégzés (respiratórikus distressz), szapora légvétel (tahipnoé), rendellenesen alacsony oxigénszint a vérben (hipoxia) és megnövekedett testhőmérséklet (láz).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik.
A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül:
Nemzeti Népegészségügyi és Gyógyszerészeti Központ, Postafiók 450, H-1372 Budapest
honlap: www.ogyei.gov.hu
elektronikus bejelentő form: https://mellekhatas.ogyei.gov.hu/
e-mail: adr.box@ogyei.gov.hu
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Pentaglobin-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon (az EXP után) feltüntetett lejárati idő után ne alkalmazza ezt a gyógyszert.
Hűtőszekrényben (2 °C - 8 °C) tárolandó. Nem fagyasztható! A fénytől való védelem érdekében az eredeti csomagolásában tárolandó.
Alkalmazása előtt a készítményt szemügyre kell venni. Az oldatnak tisztának, vagy enyhén-közepesen opalizálónak (tejszerű fényűnek) kell lennie. A Pentaglobin nem használható fel, ha az oldat zavaros vagy üledéket tartalmaz.
Az oldatot az injekciós üveg felbontása után azonnal fel kell használni! A fel nem használt felbontott készítményt meg kell semmisíteni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Pentaglobin?
- A készítmény hatóanyaga: humán immunglobulin;
1 ml oldat 50 mg humán plazmafehérjét tartalmaz, amelynek legalább 95%-a immunglobulin: 6 mg IgM, 6 mg IgA, 38 mg IgG.
- Egyéb összetevők: glükóz-monohidrát (Ph. Eur.), nátrium-klorid, injekcióhoz való víz.
Milyen a Pentaglobin külleme és mit tartalmaz a csomagolás?
A Pentaglobin kis vagy közepes mértékben opálos, színtelen vagy halványsárga oldat színtelen üvegből készült injekciós üvegben.
A Pentaglobin a következő kiszerelésekben kapható:
Egy darab, 10 ml (0,5 g), 50 ml (2,5 g) vagy 100 ml (5,0 g) oldatot tartalmazó injekciós üveg.
Fogyasztói ár:
14250Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 14250 Ft
Fogyasztói ár:
66588Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 66588 Ft
Fogyasztói ár:
132137Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 132137 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2024
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2024























