
OCTANINE 1000 NE por és oldószer oldatos injekcióhoz
ATC
IX koagulációs faktor
Hatóanyag
factor IX, heparin
OCTANINE 1000 NE por és oldószer oldatos injekcióhoz betegtájékoztatója
1. Milyen típusú gyógyszer az Octanine és milyen betegségek esetén alkalmazható?
Az Octanine a véralvadási faktorok csoportjába tartozó gyógyszer, amely emberi IX. véralvadási faktort tartalmaz. Ez egy speciális fehérje, amely fokozza a vér alvadási képességét.
Az Octanine vérzések kezelésére és megelőzésére alkalmazható vérzészavarban ("B" típusú hemofília) szenvedő betegeknél. Ez olyan betegség, amelyben a vérzés a vártnál hosszabb ideig tarthat. Ennek oka a vérben található IX. véralvadási faktor veleszületett hiánya.
Az Octanine oldatos injekció készítésére szolgáló por és oldószer formájában kerül forgalomba. Feloldás után intravénásan (vénába fecskendezve) kell beadni.
2. Tudnivalók az Octanine alkalmazása előtt
Ne alkalmazza az Octanine-t
• ha allergiás (túlérzékeny) a IX. alvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
• ha II. típusú heparin indukálta trombocitopéniában szenved, ami a vérben található vérlemezkék számának heparin beadását követő csökkenését jelenti. A vérlemezkék a vérben található sejtek, amelyek a vérzés elállításában játszanak szerepet. A heparin a vérrögképződés megakadályozására szolgáló gyógyszer.
Figyelmeztetések és óvintézkedések
Az Octanine alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
• Mint minden fehérjetartalmú, intravénásan beadott gyógyszer esetében, ennél is előfordulhatnak allergiás típusú túlérzékenységi reakciók. Az Octanine a IX. faktoron és a heparinon kívül nagyon kis mennyiségben tartalmaz más emberi fehérjéket is. A túlérzékenységi reakció korai jelei többek között:
- csalánkiütés (urtikária)
- kiütés
- mellkasi szorító érzés
- zihálás
- alacsony vérnyomás
- heveny, súlyos allergiás reakció (anafilaxia, amikor a fenti tünetek valamelyike vagy mindegyike gyorsan és súlyos formában alakul ki)
Ha ezek a tünetek jelentkeznek, akkor az injekció beadását azonnal le kell állítani, és orvoshoz kell fordulni. Anafilaxiás sokk esetén az orvosnak a lehető leghamarabb meg kell kezdenie a javasolt kezelést.
• Orvosa javasolhatja, hogy fontolja meg a hepatitisz A és B elleni védőoltást, amennyiben rendszeresen/ismételten emberi plazma eredetű IX. faktorkészítményeket kap.
• Ismeretes, hogy "B" típusú hemofíliában szenvedők esetében az immunsejtek IX. faktor elleni inhibitorokat (semlegesítő antitestek) termelhetnek. Az inhibitorok növelhetik az anafilaxiás sokk (súlyos allergiás reakciók) kialakulásának kockázatát. Ezért, ha Önnél allergiás reakció alakul ki, akkor vizsgálni kell az inhibitorok jelenlétét. A IX. faktor elleni inhibitorokkal rendelkező betegek esetében a IX. faktorral történő kezelés során fokozott lehet az anafilaxia kialakulásának kockázata. Ezért orvosa dönthet úgy, hogy az első IX. faktor injekciót orvosi felügyelet mellett adja be Önnek, olyan intézményben, ahol biztosítható az allergiás reakciók megfelelő orvosi ellátása.
• A IX. faktor fehérjekoncentrátumok vérrögképződés útján érelzáródást okozhatnak. E kockázat miatt - ami nem megfelelő tisztaságú készítmények esetében fokozott - a IX. faktorkészítmények beadását követően, a vérrögképződés jeleinek észlelése érdekében, ellenőrzésre van szükség, ha Önnél:
a fibrinolízis (vérrögök szétesésének) jelei alakulnak ki
disszeminált intravaszkuláris koaguláció (véralvadás testszerte az ereken belül) áll fenn
májbetegséget diagnosztizáltak
ismerten a szív- és érrendszeri betegségek kockázati tényezői állnak fenn
a közelmúltban sebészeti beavatkozást végeztek
fokozott a vérrögképződés vagy a disszeminált intravaszkuláris koaguláció kialakulásának kockázata.
Ha a fenti állapotok bármelyike igaz Önre, akkor kezelőorvosa kizárólag abban az esetben adja Önnek az Octanine-t, ha az alkalmazás várható előnye meghaladja annak kockázatait.
- Humán IX. alvadási faktort tartalmazó készítménnyel történő ismételt kezelést követően a betegeknél vizsgálni kell, hogy nem alakultak-e ki semlegesítő ellenanyagok (inhibitorok), és ezek mennyiségét - megfelelő biológiai vizsgálattal - Bethesda egységben (BE) kell meghatározni.
A vérkészítmények vírusbiztonsága
- Emberi vérből vagy plazmából készült gyógyszerek esetén a fertőzés betegre történő átvitelének megelőzése érdekében el kell végezni bizonyos eljárásokat. Ezek közé tartoznak a vért és plazmát adó donorok gondos kiválasztása, hogy biztosan ki lehessen zárni azokat a személyeket, akiknél fennáll a fertőzések hordozásának kockázata, valamint az összes levett anyag egyedi vizsgálata és a plazmakeverékek vizsgálata vírusok jelei szempontjából. Az ilyen típusú készítmények gyártói a vér, illetve a plazma feldolgozása során a vírusok hatástalanítására, illetve eltávolítására szolgáló eljárási lépéseket is beiktatnak. Mindezen eljárások ellenére az emberi vérből, illetve plazmából előállított gyógyszerek alkalmazása esetén a fertőzések átvitelének lehetősége nem zárható ki teljes mértékben. Ez érvényes a még esetlegesen ismeretlen vagy újonnan felbukkanó vírusokra és egyéb típusú fertőzésekre is.
- Az elvégzett eljárások hatékonynak tekinthetők a burokkal rendelkező vírusokkal, például a humán immundeficiencia vírussal (HIV, az AIDS kórókozója), hepatitisz B és hepatitisz C vírusokkal (májgyulladást okozó vírusok), valamint a burokkal nem rendelkező hepatitisz A vírussal szemben is. A burokkal nem rendelkező vírusok, például a parvovírus B19 vírus esetében ezen eljárások hatékonysága korlátozott lehet. A parvovírus B19 fertőzés veszélyes lehet terhes nők számára (magzati fertőzést okozhat) és legyengült immunrendszerű betegek, illetve a vérszegénység egyes formáiban (például sarjósejtes vagy hemolítikus anémia) szenvedők számára.
Minden egyes alkalommal, amikor Octanine készítményt kap, szigorúan ajánlott a készítmény nevének és a gyártási tétel számának dokumentálása, hogy a felhasznált tételekről legyen nyilvántartás.
Gyermekek
Ha az Octanine-t újszülöttnek adják, akkor a gyermeknél gyakran ellenőrizni kell a disszeminált intravaszkuláris koaguláció jeleit.
Egyéb gyógyszerek és az Octanine
• Az emberi IX. véralvadási faktorkészítményeknek más gyógyszerekkel való kölcsönhatása nem ismeretes.
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
Nincs tapasztalat a IX. faktor terhesség és szoptatás során történő alkalmazására vonatkozóan. Ezért a IX. faktort terhesség vagy szoptatás alatt csak egyértelműen indokolt esetben szabad alkalmazni.
Mielőtt bármilyen gyógyszert elkezdene szedni, beszéljen kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A készítmény nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
Az Octanine nátriumot tartalmaz
1 injekciós üveg Octanine 500 NE legfeljebb 69 mg nátriumot tartalmaz (a konyhasó egyik fő alkotóeleme), ami megfelel a felnőttek számára ajánlott napi maximális nátriumbevitel 3,45%-ának,
1 injekciós üveg Octanine 1000 NE pedig legfeljebb 138 mg nátriumot tartalmaz, ami megfelel a felnőttek számára ajánlott napi maximális nátriumbevitel 6,9%-ának.
Ezt kontrollált nátriumdiéta esetén figyelembe kell venni.
3. Hogyan kell alkalmazni az Octanine-t?
Az gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Az Octanine-t a mellékelt oldószerrel történő feloldást követően intravénásan (vénába fecskendezve) kell beadni.
Kizárólag a mellékelt injekciós szereléket használja. Más injekciós/infúziós szerelék használata további kockázatokat és a kezelés sikertelenségét okozhatja.
A kezelést a hemofília kezelésében jártas orvos felügyelete mellett kell megkezdeni. Az alkalmazandó Octanine mennyisége és a faktorpótló-kezelés időtartama a IX. faktor hiányának súlyosságától függ. Ezen kívül függ a vérzés helyétől és kiterjedésétől, valamint az Ön klinikai állapotától is.
Az adag kiszámítása:
Orvosa elmondja Önnek, hogy milyen gyakran, és mennyi Octanine-t kell befecskendeznie.
A IX. faktor adagját nemzetközi egységben (NE) fejezik ki. A plazma IX. faktor aktivitása a plazmában jelenlévő IX. faktor mennyiségére utal. Ezt (a normál humán vérplazmáéhoz viszonyított)%-os értékben, vagy (a vérplazmában lévő IX. faktor nemzetközi standardjához viszonyított) nemzetközi egységben fejezzük ki.
Egy nemzetközi egységnyi (NE) IX. faktoraktivitás a normál emberi vérplazma 1 ml-ében lévő IX. faktor mennyiségének felel meg. A IX. faktor szükséges adagjának kiszámítása azon a megfigyelésen alapul, hogy testtömeg-kilogrammonként 1 NE IX. faktor beadása a vérplazma IX. faktor aktivitását a normál aktivitás 1%-ával emeli. Az Ön számára szükséges adag kiszámításához megmérik a vérplazma IX. faktor aktivitását. Ez megmutatja, hogy mennyivel kell növelni az aktivitást.
A szükséges adag az alábbi képlet alapján számolható ki:
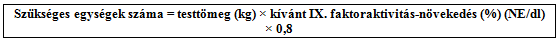
Az adagot és a kezelés gyakoriságát az orvos a gyógyszerre adott válasz alapján fogja meghatározni. A IX. faktor-készítményeket ritkán kell naponta egynél többször alkalmazni.
Szervezete IX. faktorkészítményekre adott válasza változhat. Ezért a pontos adag és az infúzió gyakoriságának meghatározása érdekében a kezelés során mérni kell a IX. faktor szintjét. Kezelőorvosa vérvizsgálatokat (a plazma IX. faktor aktivitásának mérése) fog végezni a faktorpótló kezelés gyakori ellenőrzése érdekében, különösen sebészi beavatkozások során.
Vérzés megelőzése
Súlyos "B" típusú hemofília esetén testtömeg-kilogrammonként 20-40 NE IX. faktort kell befecskendezni. Hosszú távú megelőzésre hetente kétszer kell alkalmazni ezt az adagot. Az adagot szervezete válaszának megfelelően kell módosítani. Egyes esetekben, különösen fiatalabb betegeknél gyakoribb adagolásra, illetve nagyobb adagokra lehet szükség.
Gyermekek
A 6 év alatti gyermekek körében végzett vizsgálat során, a gyógyszer alkalmazásának napjain adott adagok középértéke 40 NE/kg volt.
Ha a vérzés a semlegesítő ellenanyagok (inhibitorok) miatt nem állítható el
Ha egy injekció beadása után a IX. faktor aktivitása nem éri el a várt szintet, vagy a vérzés nem áll el a megfelelő adag beadása után, akkor értesítse kezelőorvosát. Orvosa meg fogja vizsgálni az Ön vérplazmáját, hogy lássa, nem alakultak-e ki inhibitorok (antitestek) a IX. faktorfehérje ellen. Ezek az inhibitorok csökkenthetik a IX. faktor aktivitását. Ebben az esetben előfordulhat, hogy más kezelést kell választani. Orvosa megbeszéli ezt Önnel, és szükség esetén további kezelést javasol.
Ha az előírtnál több Octanine-t alkalmazott
Emberi eredetű IX. véralvadási faktor esetében túladagolási tünetekről mindeddig nem számoltak be. A javasolt adagot azonban nem szabad túllépni.
Lásd az "Útmutató otthoni kezeléshez" című részt a kiegészítő eszközök dobozán.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
• A IX. faktor tartalmú készítményekkel kezelt betegek körében ritkán túlérzékenységet, illetve allergiás reakciókat figyeltek meg. Ezek az alábbiak lehetnek:
- a vérerek akaratlan összehúzódása (görcse) az arc, a száj és a torok duzzanatával
- az infúzió beadási helyén jelentkező égő és csípő érzés
- hidegrázás
- kipirulás
- kiütések
- fejfájás
- csalánkiütés
- alacsony vérnyomás
- fáradékonyság
- hányinger
- nyugtalanság
- szapora szívverés
- mellkasi szorító érzés
- zsibbadásérzés
- hányás
- zihálás.
Néhány esetben ezek az allergiás reakciók súlyos reakcióhoz vezethetnek, melyet anafilaxiának neveznek, és amely sokkal is járhat. Ezek a reakciók leginkább a IX. faktor elleni semlegesítő ellenanyagok kialakulásával vannak összefüggésben. Amennyiben Ön a fenti tünetek egyikét tapasztalja, kérjük, tájékoztassa kezelőorvosát.
• Ha Ön "B" típusú hemofíliában szenved, akkor szervezetében semlegesítő antitestek (inhibitorok) alakulhatnak ki a IX. faktorral szemben. Ezek az antitestek megakadályozhatják, hogy a gyógyszer megfelelően hasson. Ennek az állapotnak a neve immuntolerancia. Orvosa megbeszéli ezt Önnel, és szükség esetén további kezelést javasol.
Vizsgálatot végeztek 25, "B" típusú hemofíliában szenvedő gyermek bevonásával, akik közül 6-an korábban még nem részesültek kezelésben. A vizsgálat során nem tapasztalták inhibitorok kialakulását. Az összes injekció tolerálhatóságát "nagyon jónak" vagy "jónak" minősítették.
• Néhány B" típusú hemofíliában szenvedő, IX. faktor elleni inhibitort termelő, immuntolerancia-kezelésben részesülő betegnél, akiknek kórtörténetében allergiás reakció szerepelt, nefrózis-szindróma (súlyos vesebetegség) alakult ki.
• Ritka esetekben láz fordulhat elő.
• A nem megfelelő tisztaságú IX. faktorkészítmények ritkán vérrögképződést okozhatnak a vérereken belül. Ez az alábbi szövődmények bármelyikéhez vezethet:
- szívroham
- kiterjedt véralvadás az ereken belül (disszeminált intravaszkuláris koaguláció)
- vérrögök képződése a vénákban (vénás trombózis)
- vérrögök képződése a tüdőben (tüdőembólia).
Ezek a mellékhatások gyakrabban fordulnak elő nem megfelelő tisztaságú IX. faktorkészítmények alkalmazásakor; megfelelő tisztaságú készítmények, például az Octanine alkalmazása során előfordulásuk ritka.
• A készítmény heparin tartalma miatt a vérben található vérlemezkék száma hirtelen 100 000/mikroliter vagy a kiindulási érték 50%-a alá eshet. Ez egy allergiás reakció, az úgynevezett "II. típusú heparin indukálta trombocitopénia". A heparinnal szemben túlérzékenységet korábban nem mutató betegeknél a vérlemezkék számának csökkenése ritka esetekben a kezelés kezdete utáni 6-14. napon következhet be. Olyan betegeknél, akiknél korábban már előfordult túlérzékenységi reakció a heparinnal szemben, ez a változás már a kezelést követő néhány órán belül kialakulhat. A vérlemezkeszám-csökkenés e súlyos formájának kísérőjelenségei, illetve következményei az alábbiak lehetnek:
- vérrögök képződése az artériákban és a vénákban
- érelzáródás egy másik területről érkező vérrög miatt
- súlyos véralvadási zavar, melyet konszumpciós koagulopátiának neveznek
- az injekció beadásának területén kialakuló bőrelhalás
- bolhacsípésszerű vérzés
- lila véraláfutás
- szurokszéklet.
Ha a fenti allergiás reakciókat tapasztalja, akkor azonnal hagyja abba az Octanine injekció alkalmazását, és a jövőben ne alkalmazzon heparin tartalmú gyógyszereket.
A vérlemezkékre gyakorolt ezen ritka hatás miatt, kezelőorvosának gyakran ellenőriznie kell a vérlemezkeszámot, különösen a kezelés kezdetén.
Az átvihető kórokozókra vonatkozó biztonsági tudnivalókat lásd a 2. "Az Octanine fokozott elővigyázatossággal alkalmazható" pontban.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell az Octanine-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Legfeljebb 25 °C-on tárolandó.
Nem fagyasztható!
A fénytől való védelem érdekében az injekciós üveget tartsa a dobozában.
A címkén és a dobozon feltüntetett lejárati idő (Felhasználható: hónap/év) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Az elkészített oldatot javasolt azonnal felhasználni, de legfeljebb 8 órán belül, szobahőmérsékleten (25 °C) tárolva.
Az Octanine csak egy alkalommal használható fel. Zavaros vagy részlegesen feloldódott anyagot tartalmazó oldatot nem szabad felhasználni. A fel nem használt anyagokat el kell dobni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz az Octanine?
- A készítmény hatóanyaga a humán IX. véralvadási faktor.
- Egyéb összetevők: heparin, nátrium-klorid, trinátrium-citrát, arginin-hidroklorid és lizin-hidroklorid.
Milyen az Octanine külleme és mit tartalmaz a csomagolás?
Fehér vagy halványsárga színű liofilizált por vagy laza szerkezetű szilárd anyag.
Az Octanine az alábbi kétféle hatáserősségű kiszerelésben kerül forgalomba:
Octanine 500 NE por és oldószer oldatos injekcióhoz.
500 NE humán IX. véralvadási faktort tartalmaz injekciós üvegenként.
A készítmény körülbelül 100 NE/ml humán IX. alvadási faktort tartalmaz 5 ml injekcióhoz való vízben történő feloldás után.
Octanine 1000 NE por és oldószer oldatos injekcióhoz
1000 NE humán IX. véralvadási faktort tartalmaz injekciós üvegenként.
A készítmény körülbelül 100 NE/ml humán IX. alvadási faktort tartalmaz 10 ml injekcióhoz való vízben történő feloldás után.
Az OCTANINE humán donorok plazmájából készül.
A IX. faktor hatóértékének (NE) meghatározása az Európai Gyógyszerkönyvben megadott egylépéses alvadási teszttel történik, az Egészségügyi Világszervezet (World Health Organisation, WHO) egy nemzetközi standardjával összehasonlítva. Az Octanine specifikus aktivitása körülbelül 100 NE/mg fehérje.
A csomagolás leírása:
Az Octanine műanyag fóliával összekapcsolt két dobozból álló kombinált csomagolásban kerül forgalomba:
Az egyik doboz 1 darab, oldatos injekcióhoz való port tartalmazó injekciós üveget, valamint a betegtájékoztatót tartalmazza.
A másik doboz az oldószert (injekcióhoz való vizet) tartalmazó injekciós üveget tartalmazza, 5 ml-t az Octanine 500 NE és 10 ml-t az Octanine 1000 NE készítményhez.
Ez a csomag még az alábbi egészségügyi eszközöket tartalmazza:
• 1 darab egyszer használatos fecskendő
• 1 darab Mix2Vial áttöltő eszköz
• 1 darab infúziós szerelék (szárnyas tű)
• 2 darab alkoholos törlő
Otthoni kezelésre vonatkozó utasítások
- Kérjük, gondosan olvassa el az utasításokat, és pontosan kövesse azokat!
- Az alábbiakban leírt eljárás során a sterilitás szabályait mindvégig be kell tartani!
- A címkén és a dobozon feltüntetett lejárati idő után ne alkalmazza az Octanine-t.
- A fecskendőben lévő oldatnak átlátszónak vagy gyöngyházfénnyel enyhén csillogónak kell lennie. Ne fecskendezze be az oldatot, ha zavaros vagy csapadék látható benne.
- A mikrobák általi szennyeződés elkerülése érdekében azonnal használja fel az elkészített oldatot.
- Kizárólag a mellékelt injekciós készletet alkalmazza. Más injekciós/infúziós eszközök alkalmazása további kockázatokhoz és a kezelés sikertelenségéhez vezethet.
Utasítások az oldat elkészítéséhez:

Utasítások az injekció beadásához:
A biztonság kedvéért a beteg pulzusát a befecskendezés előtt és annak folyamán mérni kell. Ha a pulzus észrevehetően emelkedik, akkor a befecskendezés sebességét le kell lassítani, vagy a beadást rövid ideig meg kell szakítani.
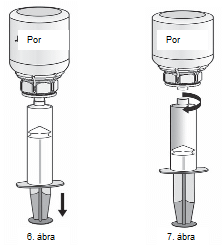
1. Csatlakoztassa a fecskendőt a Mix2Vial átlátszó részéhez. Fordítsa az injekciós üveget tetejével lefelé, és szívjon oldatot a fecskendőbe (6. ábra).
A fecskendőben lévő oldatnak átlátszónak vagy gyöngyházfénnyel enyhén csillogónak kell lennie.
Ha az oldat átkerült a fecskendőbe, akkor tartsa stabilan a fecskendő dugattyúját (úgy, hogy az lefelé nézzen), majd távolítsa el a fecskendőt a Mix2Vial-ról (7. ábra). Dobja ki a Mix2Vial-t és az üres üveget.
2. Az egyik mellékelt alkoholos törlő segítségével tisztítsa meg a megszúrandó bőrfelületet.
3. Csatlakoztassa a mellékelt injekciós tűt a fecskendőhöz.
4. Szúrja az injekciós tűt a kiválasztott vénába. Amennyiben leszorítást alkalmazott a véna jobb észlelhetősége céljából, akkor ezt a leszorítást az Octanine beadása előtt fel kell engedni.
A fibrinalvadékok képződésének veszélye miatt nem szabad hagyni, hogy a vér visszafolyjon a fecskendőbe.
5. A gyógyszert lassan, nem gyorsabban, mint 2-3 ml/perc, fecskendezze be a vénába.
Ha Ön egynél több injekciós üveg Octanine koncentrátumot alkalmaz, akkor használhatja újra ugyanazt az injekciós tűt és fecskendőt. A Mix2Vial csak egyszer használatos.
Az Octanine a véralvadási faktorok csoportjába tartozó gyógyszer, amely emberi IX. véralvadási faktort tartalmaz. Ez egy speciális fehérje, amely fokozza a vér alvadási képességét.
Az Octanine vérzések kezelésére és megelőzésére alkalmazható vérzészavarban ("B" típusú hemofília) szenvedő betegeknél. Ez olyan betegség, amelyben a vérzés a vártnál hosszabb ideig tarthat. Ennek oka a vérben található IX. véralvadási faktor veleszületett hiánya.
Az Octanine oldatos injekció készítésére szolgáló por és oldószer formájában kerül forgalomba. Feloldás után intravénásan (vénába fecskendezve) kell beadni.
2. Tudnivalók az Octanine alkalmazása előtt
Ne alkalmazza az Octanine-t
• ha allergiás (túlérzékeny) a IX. alvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
• ha II. típusú heparin indukálta trombocitopéniában szenved, ami a vérben található vérlemezkék számának heparin beadását követő csökkenését jelenti. A vérlemezkék a vérben található sejtek, amelyek a vérzés elállításában játszanak szerepet. A heparin a vérrögképződés megakadályozására szolgáló gyógyszer.
Figyelmeztetések és óvintézkedések
Az Octanine alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
• Mint minden fehérjetartalmú, intravénásan beadott gyógyszer esetében, ennél is előfordulhatnak allergiás típusú túlérzékenységi reakciók. Az Octanine a IX. faktoron és a heparinon kívül nagyon kis mennyiségben tartalmaz más emberi fehérjéket is. A túlérzékenységi reakció korai jelei többek között:
- csalánkiütés (urtikária)
- kiütés
- mellkasi szorító érzés
- zihálás
- alacsony vérnyomás
- heveny, súlyos allergiás reakció (anafilaxia, amikor a fenti tünetek valamelyike vagy mindegyike gyorsan és súlyos formában alakul ki)
Ha ezek a tünetek jelentkeznek, akkor az injekció beadását azonnal le kell állítani, és orvoshoz kell fordulni. Anafilaxiás sokk esetén az orvosnak a lehető leghamarabb meg kell kezdenie a javasolt kezelést.
• Orvosa javasolhatja, hogy fontolja meg a hepatitisz A és B elleni védőoltást, amennyiben rendszeresen/ismételten emberi plazma eredetű IX. faktorkészítményeket kap.
• Ismeretes, hogy "B" típusú hemofíliában szenvedők esetében az immunsejtek IX. faktor elleni inhibitorokat (semlegesítő antitestek) termelhetnek. Az inhibitorok növelhetik az anafilaxiás sokk (súlyos allergiás reakciók) kialakulásának kockázatát. Ezért, ha Önnél allergiás reakció alakul ki, akkor vizsgálni kell az inhibitorok jelenlétét. A IX. faktor elleni inhibitorokkal rendelkező betegek esetében a IX. faktorral történő kezelés során fokozott lehet az anafilaxia kialakulásának kockázata. Ezért orvosa dönthet úgy, hogy az első IX. faktor injekciót orvosi felügyelet mellett adja be Önnek, olyan intézményben, ahol biztosítható az allergiás reakciók megfelelő orvosi ellátása.
• A IX. faktor fehérjekoncentrátumok vérrögképződés útján érelzáródást okozhatnak. E kockázat miatt - ami nem megfelelő tisztaságú készítmények esetében fokozott - a IX. faktorkészítmények beadását követően, a vérrögképződés jeleinek észlelése érdekében, ellenőrzésre van szükség, ha Önnél:
a fibrinolízis (vérrögök szétesésének) jelei alakulnak ki
disszeminált intravaszkuláris koaguláció (véralvadás testszerte az ereken belül) áll fenn
májbetegséget diagnosztizáltak
ismerten a szív- és érrendszeri betegségek kockázati tényezői állnak fenn
a közelmúltban sebészeti beavatkozást végeztek
fokozott a vérrögképződés vagy a disszeminált intravaszkuláris koaguláció kialakulásának kockázata.
Ha a fenti állapotok bármelyike igaz Önre, akkor kezelőorvosa kizárólag abban az esetben adja Önnek az Octanine-t, ha az alkalmazás várható előnye meghaladja annak kockázatait.
- Humán IX. alvadási faktort tartalmazó készítménnyel történő ismételt kezelést követően a betegeknél vizsgálni kell, hogy nem alakultak-e ki semlegesítő ellenanyagok (inhibitorok), és ezek mennyiségét - megfelelő biológiai vizsgálattal - Bethesda egységben (BE) kell meghatározni.
A vérkészítmények vírusbiztonsága
- Emberi vérből vagy plazmából készült gyógyszerek esetén a fertőzés betegre történő átvitelének megelőzése érdekében el kell végezni bizonyos eljárásokat. Ezek közé tartoznak a vért és plazmát adó donorok gondos kiválasztása, hogy biztosan ki lehessen zárni azokat a személyeket, akiknél fennáll a fertőzések hordozásának kockázata, valamint az összes levett anyag egyedi vizsgálata és a plazmakeverékek vizsgálata vírusok jelei szempontjából. Az ilyen típusú készítmények gyártói a vér, illetve a plazma feldolgozása során a vírusok hatástalanítására, illetve eltávolítására szolgáló eljárási lépéseket is beiktatnak. Mindezen eljárások ellenére az emberi vérből, illetve plazmából előállított gyógyszerek alkalmazása esetén a fertőzések átvitelének lehetősége nem zárható ki teljes mértékben. Ez érvényes a még esetlegesen ismeretlen vagy újonnan felbukkanó vírusokra és egyéb típusú fertőzésekre is.
- Az elvégzett eljárások hatékonynak tekinthetők a burokkal rendelkező vírusokkal, például a humán immundeficiencia vírussal (HIV, az AIDS kórókozója), hepatitisz B és hepatitisz C vírusokkal (májgyulladást okozó vírusok), valamint a burokkal nem rendelkező hepatitisz A vírussal szemben is. A burokkal nem rendelkező vírusok, például a parvovírus B19 vírus esetében ezen eljárások hatékonysága korlátozott lehet. A parvovírus B19 fertőzés veszélyes lehet terhes nők számára (magzati fertőzést okozhat) és legyengült immunrendszerű betegek, illetve a vérszegénység egyes formáiban (például sarjósejtes vagy hemolítikus anémia) szenvedők számára.
Minden egyes alkalommal, amikor Octanine készítményt kap, szigorúan ajánlott a készítmény nevének és a gyártási tétel számának dokumentálása, hogy a felhasznált tételekről legyen nyilvántartás.
Gyermekek
Ha az Octanine-t újszülöttnek adják, akkor a gyermeknél gyakran ellenőrizni kell a disszeminált intravaszkuláris koaguláció jeleit.
Egyéb gyógyszerek és az Octanine
• Az emberi IX. véralvadási faktorkészítményeknek más gyógyszerekkel való kölcsönhatása nem ismeretes.
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
Nincs tapasztalat a IX. faktor terhesség és szoptatás során történő alkalmazására vonatkozóan. Ezért a IX. faktort terhesség vagy szoptatás alatt csak egyértelműen indokolt esetben szabad alkalmazni.
Mielőtt bármilyen gyógyszert elkezdene szedni, beszéljen kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A készítmény nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
Az Octanine nátriumot tartalmaz
1 injekciós üveg Octanine 500 NE legfeljebb 69 mg nátriumot tartalmaz (a konyhasó egyik fő alkotóeleme), ami megfelel a felnőttek számára ajánlott napi maximális nátriumbevitel 3,45%-ának,
1 injekciós üveg Octanine 1000 NE pedig legfeljebb 138 mg nátriumot tartalmaz, ami megfelel a felnőttek számára ajánlott napi maximális nátriumbevitel 6,9%-ának.
Ezt kontrollált nátriumdiéta esetén figyelembe kell venni.
3. Hogyan kell alkalmazni az Octanine-t?
Az gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Az Octanine-t a mellékelt oldószerrel történő feloldást követően intravénásan (vénába fecskendezve) kell beadni.
Kizárólag a mellékelt injekciós szereléket használja. Más injekciós/infúziós szerelék használata további kockázatokat és a kezelés sikertelenségét okozhatja.
A kezelést a hemofília kezelésében jártas orvos felügyelete mellett kell megkezdeni. Az alkalmazandó Octanine mennyisége és a faktorpótló-kezelés időtartama a IX. faktor hiányának súlyosságától függ. Ezen kívül függ a vérzés helyétől és kiterjedésétől, valamint az Ön klinikai állapotától is.
Az adag kiszámítása:
Orvosa elmondja Önnek, hogy milyen gyakran, és mennyi Octanine-t kell befecskendeznie.
A IX. faktor adagját nemzetközi egységben (NE) fejezik ki. A plazma IX. faktor aktivitása a plazmában jelenlévő IX. faktor mennyiségére utal. Ezt (a normál humán vérplazmáéhoz viszonyított)%-os értékben, vagy (a vérplazmában lévő IX. faktor nemzetközi standardjához viszonyított) nemzetközi egységben fejezzük ki.
Egy nemzetközi egységnyi (NE) IX. faktoraktivitás a normál emberi vérplazma 1 ml-ében lévő IX. faktor mennyiségének felel meg. A IX. faktor szükséges adagjának kiszámítása azon a megfigyelésen alapul, hogy testtömeg-kilogrammonként 1 NE IX. faktor beadása a vérplazma IX. faktor aktivitását a normál aktivitás 1%-ával emeli. Az Ön számára szükséges adag kiszámításához megmérik a vérplazma IX. faktor aktivitását. Ez megmutatja, hogy mennyivel kell növelni az aktivitást.
A szükséges adag az alábbi képlet alapján számolható ki:
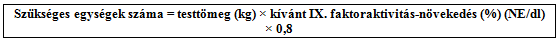
Az adagot és a kezelés gyakoriságát az orvos a gyógyszerre adott válasz alapján fogja meghatározni. A IX. faktor-készítményeket ritkán kell naponta egynél többször alkalmazni.
Szervezete IX. faktorkészítményekre adott válasza változhat. Ezért a pontos adag és az infúzió gyakoriságának meghatározása érdekében a kezelés során mérni kell a IX. faktor szintjét. Kezelőorvosa vérvizsgálatokat (a plazma IX. faktor aktivitásának mérése) fog végezni a faktorpótló kezelés gyakori ellenőrzése érdekében, különösen sebészi beavatkozások során.
Vérzés megelőzése
Súlyos "B" típusú hemofília esetén testtömeg-kilogrammonként 20-40 NE IX. faktort kell befecskendezni. Hosszú távú megelőzésre hetente kétszer kell alkalmazni ezt az adagot. Az adagot szervezete válaszának megfelelően kell módosítani. Egyes esetekben, különösen fiatalabb betegeknél gyakoribb adagolásra, illetve nagyobb adagokra lehet szükség.
Gyermekek
A 6 év alatti gyermekek körében végzett vizsgálat során, a gyógyszer alkalmazásának napjain adott adagok középértéke 40 NE/kg volt.
Ha a vérzés a semlegesítő ellenanyagok (inhibitorok) miatt nem állítható el
Ha egy injekció beadása után a IX. faktor aktivitása nem éri el a várt szintet, vagy a vérzés nem áll el a megfelelő adag beadása után, akkor értesítse kezelőorvosát. Orvosa meg fogja vizsgálni az Ön vérplazmáját, hogy lássa, nem alakultak-e ki inhibitorok (antitestek) a IX. faktorfehérje ellen. Ezek az inhibitorok csökkenthetik a IX. faktor aktivitását. Ebben az esetben előfordulhat, hogy más kezelést kell választani. Orvosa megbeszéli ezt Önnel, és szükség esetén további kezelést javasol.
Ha az előírtnál több Octanine-t alkalmazott
Emberi eredetű IX. véralvadási faktor esetében túladagolási tünetekről mindeddig nem számoltak be. A javasolt adagot azonban nem szabad túllépni.
Lásd az "Útmutató otthoni kezeléshez" című részt a kiegészítő eszközök dobozán.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
• A IX. faktor tartalmú készítményekkel kezelt betegek körében ritkán túlérzékenységet, illetve allergiás reakciókat figyeltek meg. Ezek az alábbiak lehetnek:
- a vérerek akaratlan összehúzódása (görcse) az arc, a száj és a torok duzzanatával
- az infúzió beadási helyén jelentkező égő és csípő érzés
- hidegrázás
- kipirulás
- kiütések
- fejfájás
- csalánkiütés
- alacsony vérnyomás
- fáradékonyság
- hányinger
- nyugtalanság
- szapora szívverés
- mellkasi szorító érzés
- zsibbadásérzés
- hányás
- zihálás.
Néhány esetben ezek az allergiás reakciók súlyos reakcióhoz vezethetnek, melyet anafilaxiának neveznek, és amely sokkal is járhat. Ezek a reakciók leginkább a IX. faktor elleni semlegesítő ellenanyagok kialakulásával vannak összefüggésben. Amennyiben Ön a fenti tünetek egyikét tapasztalja, kérjük, tájékoztassa kezelőorvosát.
• Ha Ön "B" típusú hemofíliában szenved, akkor szervezetében semlegesítő antitestek (inhibitorok) alakulhatnak ki a IX. faktorral szemben. Ezek az antitestek megakadályozhatják, hogy a gyógyszer megfelelően hasson. Ennek az állapotnak a neve immuntolerancia. Orvosa megbeszéli ezt Önnel, és szükség esetén további kezelést javasol.
Vizsgálatot végeztek 25, "B" típusú hemofíliában szenvedő gyermek bevonásával, akik közül 6-an korábban még nem részesültek kezelésben. A vizsgálat során nem tapasztalták inhibitorok kialakulását. Az összes injekció tolerálhatóságát "nagyon jónak" vagy "jónak" minősítették.
• Néhány B" típusú hemofíliában szenvedő, IX. faktor elleni inhibitort termelő, immuntolerancia-kezelésben részesülő betegnél, akiknek kórtörténetében allergiás reakció szerepelt, nefrózis-szindróma (súlyos vesebetegség) alakult ki.
• Ritka esetekben láz fordulhat elő.
• A nem megfelelő tisztaságú IX. faktorkészítmények ritkán vérrögképződést okozhatnak a vérereken belül. Ez az alábbi szövődmények bármelyikéhez vezethet:
- szívroham
- kiterjedt véralvadás az ereken belül (disszeminált intravaszkuláris koaguláció)
- vérrögök képződése a vénákban (vénás trombózis)
- vérrögök képződése a tüdőben (tüdőembólia).
Ezek a mellékhatások gyakrabban fordulnak elő nem megfelelő tisztaságú IX. faktorkészítmények alkalmazásakor; megfelelő tisztaságú készítmények, például az Octanine alkalmazása során előfordulásuk ritka.
• A készítmény heparin tartalma miatt a vérben található vérlemezkék száma hirtelen 100 000/mikroliter vagy a kiindulási érték 50%-a alá eshet. Ez egy allergiás reakció, az úgynevezett "II. típusú heparin indukálta trombocitopénia". A heparinnal szemben túlérzékenységet korábban nem mutató betegeknél a vérlemezkék számának csökkenése ritka esetekben a kezelés kezdete utáni 6-14. napon következhet be. Olyan betegeknél, akiknél korábban már előfordult túlérzékenységi reakció a heparinnal szemben, ez a változás már a kezelést követő néhány órán belül kialakulhat. A vérlemezkeszám-csökkenés e súlyos formájának kísérőjelenségei, illetve következményei az alábbiak lehetnek:
- vérrögök képződése az artériákban és a vénákban
- érelzáródás egy másik területről érkező vérrög miatt
- súlyos véralvadási zavar, melyet konszumpciós koagulopátiának neveznek
- az injekció beadásának területén kialakuló bőrelhalás
- bolhacsípésszerű vérzés
- lila véraláfutás
- szurokszéklet.
Ha a fenti allergiás reakciókat tapasztalja, akkor azonnal hagyja abba az Octanine injekció alkalmazását, és a jövőben ne alkalmazzon heparin tartalmú gyógyszereket.
A vérlemezkékre gyakorolt ezen ritka hatás miatt, kezelőorvosának gyakran ellenőriznie kell a vérlemezkeszámot, különösen a kezelés kezdetén.
Az átvihető kórokozókra vonatkozó biztonsági tudnivalókat lásd a 2. "Az Octanine fokozott elővigyázatossággal alkalmazható" pontban.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell az Octanine-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Legfeljebb 25 °C-on tárolandó.
Nem fagyasztható!
A fénytől való védelem érdekében az injekciós üveget tartsa a dobozában.
A címkén és a dobozon feltüntetett lejárati idő (Felhasználható: hónap/év) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Az elkészített oldatot javasolt azonnal felhasználni, de legfeljebb 8 órán belül, szobahőmérsékleten (25 °C) tárolva.
Az Octanine csak egy alkalommal használható fel. Zavaros vagy részlegesen feloldódott anyagot tartalmazó oldatot nem szabad felhasználni. A fel nem használt anyagokat el kell dobni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz az Octanine?
- A készítmény hatóanyaga a humán IX. véralvadási faktor.
- Egyéb összetevők: heparin, nátrium-klorid, trinátrium-citrát, arginin-hidroklorid és lizin-hidroklorid.
Milyen az Octanine külleme és mit tartalmaz a csomagolás?
Fehér vagy halványsárga színű liofilizált por vagy laza szerkezetű szilárd anyag.
Az Octanine az alábbi kétféle hatáserősségű kiszerelésben kerül forgalomba:
Octanine 500 NE por és oldószer oldatos injekcióhoz.
500 NE humán IX. véralvadási faktort tartalmaz injekciós üvegenként.
A készítmény körülbelül 100 NE/ml humán IX. alvadási faktort tartalmaz 5 ml injekcióhoz való vízben történő feloldás után.
Octanine 1000 NE por és oldószer oldatos injekcióhoz
1000 NE humán IX. véralvadási faktort tartalmaz injekciós üvegenként.
A készítmény körülbelül 100 NE/ml humán IX. alvadási faktort tartalmaz 10 ml injekcióhoz való vízben történő feloldás után.
Az OCTANINE humán donorok plazmájából készül.
A IX. faktor hatóértékének (NE) meghatározása az Európai Gyógyszerkönyvben megadott egylépéses alvadási teszttel történik, az Egészségügyi Világszervezet (World Health Organisation, WHO) egy nemzetközi standardjával összehasonlítva. Az Octanine specifikus aktivitása körülbelül 100 NE/mg fehérje.
A csomagolás leírása:
Az Octanine műanyag fóliával összekapcsolt két dobozból álló kombinált csomagolásban kerül forgalomba:
Az egyik doboz 1 darab, oldatos injekcióhoz való port tartalmazó injekciós üveget, valamint a betegtájékoztatót tartalmazza.
A másik doboz az oldószert (injekcióhoz való vizet) tartalmazó injekciós üveget tartalmazza, 5 ml-t az Octanine 500 NE és 10 ml-t az Octanine 1000 NE készítményhez.
Ez a csomag még az alábbi egészségügyi eszközöket tartalmazza:
• 1 darab egyszer használatos fecskendő
• 1 darab Mix2Vial áttöltő eszköz
• 1 darab infúziós szerelék (szárnyas tű)
• 2 darab alkoholos törlő
Otthoni kezelésre vonatkozó utasítások
- Kérjük, gondosan olvassa el az utasításokat, és pontosan kövesse azokat!
- Az alábbiakban leírt eljárás során a sterilitás szabályait mindvégig be kell tartani!
- A címkén és a dobozon feltüntetett lejárati idő után ne alkalmazza az Octanine-t.
- A fecskendőben lévő oldatnak átlátszónak vagy gyöngyházfénnyel enyhén csillogónak kell lennie. Ne fecskendezze be az oldatot, ha zavaros vagy csapadék látható benne.
- A mikrobák általi szennyeződés elkerülése érdekében azonnal használja fel az elkészített oldatot.
- Kizárólag a mellékelt injekciós készletet alkalmazza. Más injekciós/infúziós eszközök alkalmazása további kockázatokhoz és a kezelés sikertelenségéhez vezethet.
Utasítások az oldat elkészítéséhez:

Utasítások az injekció beadásához:
A biztonság kedvéért a beteg pulzusát a befecskendezés előtt és annak folyamán mérni kell. Ha a pulzus észrevehetően emelkedik, akkor a befecskendezés sebességét le kell lassítani, vagy a beadást rövid ideig meg kell szakítani.
1. Csatlakoztassa a fecskendőt a Mix2Vial átlátszó részéhez. Fordítsa az injekciós üveget tetejével lefelé, és szívjon oldatot a fecskendőbe (6. ábra).
A fecskendőben lévő oldatnak átlátszónak vagy gyöngyházfénnyel enyhén csillogónak kell lennie.
Ha az oldat átkerült a fecskendőbe, akkor tartsa stabilan a fecskendő dugattyúját (úgy, hogy az lefelé nézzen), majd távolítsa el a fecskendőt a Mix2Vial-ról (7. ábra). Dobja ki a Mix2Vial-t és az üres üveget.

2. Az egyik mellékelt alkoholos törlő segítségével tisztítsa meg a megszúrandó bőrfelületet.
3. Csatlakoztassa a mellékelt injekciós tűt a fecskendőhöz.
4. Szúrja az injekciós tűt a kiválasztott vénába. Amennyiben leszorítást alkalmazott a véna jobb észlelhetősége céljából, akkor ezt a leszorítást az Octanine beadása előtt fel kell engedni.
A fibrinalvadékok képződésének veszélye miatt nem szabad hagyni, hogy a vér visszafolyjon a fecskendőbe.
5. A gyógyszert lassan, nem gyorsabban, mint 2-3 ml/perc, fecskendezze be a vénába.
Ha Ön egynél több injekciós üveg Octanine koncentrátumot alkalmaz, akkor használhatja újra ugyanazt az injekciós tűt és fecskendőt. A Mix2Vial csak egyszer használatos.
Fogyasztói ár:
115570Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 115570 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026


















