
KOGENATE BAYER 1000 NE por és oldószer oldatos injekcióhoz
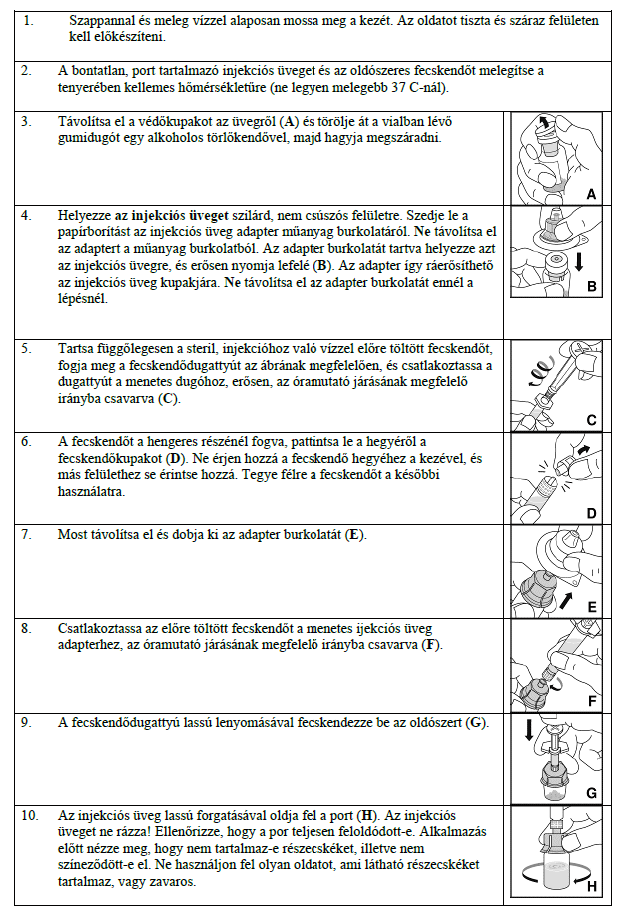
ATC
VIII koagulációs faktor
Hatóanyag
octocog alfa
KOGENATE BAYER 1000 NE por és oldószer oldatos injekcióhoz betegtájékoztatója
1. Milyen típusú gyógyszer a KOGENATE Bayer és milyen betegségek esetén alkalmazható?
A KOGENATE Bayer rekombináns humán VIII. véralvadási faktor hatóanyagot (alfa-oktokogot) tartalmaz.
A KOGENATE Bayer vérzés kezelésére vagy megelőzésére ajánlott A-típusú hemofília (a VIII. faktor örökletes hiánya) esetén felnőtteknek, serdülőknek és bármely korosztályba tartozó gyermekeknek.
A készítmény nem tartalmaz von Willebrand-faktort, ezért von Willebrand-betegség esetén nem alkalmazható.
2. Tudnivalók KOGENATE Bayer alkalmazása előtt
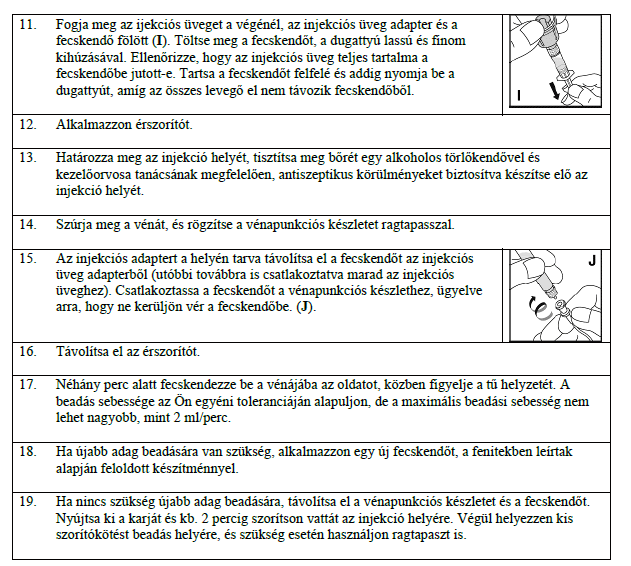
Ne alkalmazza a KOGENATE Bayer készítményt,
- ha allergiás az alfa-oktokogra vagy a gyógyszer (6. pontban és a 2. pont végén felsorolt) egyéb összetevőjére.
- ha allergiás az egér- vagy hörcsögfehérjére.
Ha nem biztos benne, kérdezze meg erről kezelőorvosát.
Figyelmeztetések és óvintézkedések
A KOGENATE Bayerfokozott elővigyázatossággal, alkalmazható, és beszéljen kezelőorvosával vagy gyógyszerészével, ha:
- mellkasi szorító érzést, szédülést tapasztal, rosszul érzi magát, hirtelen elgyengül vagy állva szédül, lehet, hogy ritka, súlyos, hirtelen fellépő allergiás reakciót tapasztal (az úgynevezett anafilaxiás reakciót) erre a gyógyszerre. Ha ezeket a tüneteket észleli, azonnal hagyja abba a készítmény alkalmazását, és forduljon orvoshoz.
- Előfordulhat, hogy orvosa vizsgálatokat végezhet el annak megállapítására, hogy a gyógyszer alkalmazott adagja biztosítja-e a VIII. faktor megfelelő vérszintjét.
- a vérzése a gyógyszer általában alkalmazott adagjával nem szüntethető meg Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem állítható el Önnél, illetve gyermekénél a KOGENATE Bayer készítménnyel, azonnal tájékoztassa erről kezelőorvosát.
- Önnél korábban VIII. faktor inhibitor alakult ki, és más VIII. faktor készítményre vált, akkor fennáll a kockázata annak, hogy ez az inhibitor ismét megjelenik.
- korábban azt mondták Önnek, hogy szívbetegségben szenved, vagy szívbetegség kockázata áll fenn Önnél, tájékoztassa kezelőorvosát vagy gyógyszerészét.
- a KOGENATE Bayer beadásához Önnél egy centrális vénás kanülre van szükség. A centrális vénás kanüllel kapcsolatos szövődmények kockázata állhat fenn, beleértve a helyi fertőzéseket, a baktériumok véráramba kerülését (bakterémia), valamint a kanül bevezetésének helyén az érben kialakó vérrögöt (trombózis).
Előfordulhat, hogy orvosa vizsgálatokat végezhet el annak megállapítására, hogy a gyógyszer alkalmazott adagja biztosítja-e a VIII. faktor megfelelő vérszintjét.
Egyéb gyógyszerek és a KOGENATE Bayer
Bár más gyógyszerkészítménnyel való kölcsönhatás nem ismert, feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, szedni tervezett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Gyermekek és serdülők
A felsorolt figyelmeztetések és óvintézkedésekminden életkorú felnőttre és gyermekre vonatkoznak.
Terhesség, szoptatás és termékenység
A KOGENATE Bayer terhesség és szoptatás alatti használatával, valamint a termékenységre kifejtett hatásával kapcsolatban nincsenek tapasztalatok. Ezért, ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége, vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
KOGENATE Bayer nincs hatással a férfi vagy női termékenységre, mivel a hatóanyaga a testben természetes módon jelen van.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
A készítménynek a gépjárművezetéshez és gépek kezeléséhez szükséges képességeket befolyásoló hatását nem észlelték.
A KOGENATE Bayer nátriumot tartalmaz
A készítmény kevesebb mint 1 mml (23 mg) nátriumot tartalmaz injekciós üvegenként, azaz gyakorlatilag nátriummentes.
Nyilvántartás
Javasolt, hogy minden alkalommal, amikor Ön KOGENATE Bayer -t alkalmaz, jegyezze fel a készítmény nevét és gyártási számát.
3. Hogyan kell alkalmazni a KOGENATE Bayer készítményt?
Ezt a gyógyszert mindig pontosan a betegtájékoztatóban leírtaknak, vagy az Ön kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát, gyógyszerészét vagy a nővért.
Vérzés kezelése
Orvosa ki fogja számítani a gyógyszer adagját és azt, hogy milyen gyakran kell alkalmaznia, hogy elérje a szükséges VIII. faktor aktivitási szintet a vérében. A gyógyszer alkalmazott mennyiségét és adagolási gyakoriságát orvosa mindig az Ön egyéni szükségleteinek megfelelően állítja be. Azt, hogy mennyi KOGENATE Bayer-t kell alkalmaznia és milyen gyakorisággal kell használnia több tényező befolyásolja, mint például:
- az Ön testtömege
- az Ön hemofíliájának súlyossága
- a vérzés helye és súlyossága
- az inhibitorok megléte és mennyisége és milyen magas a titráció
- a szükséges VIII. faktor szint
Vérzés megelőzése
Ha a KOGENATE Bayer-t a vérzés megelőzésére használja (profilaxis), orvosa kiszámítja az Önnek megfelelő adagot. Ez általában testtömeg-kilogrammonként 20-40 NE alfa-oktokog, minden 2.-3. napon adva. Azonban egyes esetekben, különösen fiatal betegeknél, rövidebb adagolási időközök vagy magasabb adagok adása válhatnak szükségessé.
Laboratóriumi vizsgálatok
Hangsúlyozottan ajánlott a plazma megfelelő időközönkénti laboratóriumi vizsgálatának elvégzése annak ellenőrzésére, hogy sikerült-e elérni és fenntartani a szükséges VIII. faktor aktivitási szintet. Különösen nagyobb műtéteknél szükséges a faktorpótló terápia véralvadási vizsgálattal történő pontos monitorozása.
Gyermekek és serdülők
A KOGENATE Bayer bármilyen életkorú gyermekenél alkalmazható.
Ha a vérzés nem állítható el
Amennyiben a VIII. faktor várt aktivitási szintjét a plazmában nem sikerül elérni, vagy ha a vérzés a nyilvánvalóan megfelelő adaggal nem állítható el, előfordulhat, hogy a vérében VIII. faktor inhibitor van jelen. Ezt egy abban jártas szakembernek ellenőriznie kell.
Ha ezen gyógyszer alkalmazása során annak hatását túlzottan erősnek, vagy csekélynek érzi, forduljon orvosához vagy gyógyszerészéhez.
Inhibitorok jelenléte
Ha orvosa azt mondta Önnek, hogy vérében VIII. faktor inhibitorok alakultak ki, akkor előfordulhat, hogy nagyobb mennyiségű gyógyszert kell használnia a vérzés csillapítására. Amennyiben ez az adag nem szünteti hatásosan a vérzést, orvosa a kezelést kiegészítő készítmény - VIIa faktor koncentrátum vagy (aktivált) protrombin komplex koncentrátum - adása mellett dönthet.
Az ilyen kezeléseket az A-típusú haemophilia kezelésében tapasztalt orvos írhatja elő. További információért forduljon orvosához.
Az orvosával történő egyeztetés nélkül ne növelje a vérzés csillapítására használt gyógyszer adagját.
A beadás sebessége
Ezt a gyógyszert intravénásan kell beadni több perces időtartam alatt. A beadás sebességét a beteg komfortérzése határozza meg (maximális injektálási sebesség: 2 ml/perc).
A kezelés időtartama
Orvosa megmondja Önnek, hogy ezt a gyógyszert milyen gyakran, milyen időközönként kell használnia.A KOGENATE Bayer készítménnyel végzett faktorpótló terápia általában élethosszig tart.
Hogyan kell beadni a Kogenate Bayer-t
Ez a gyógyszert a vénába kell beadni injekció formájában, 2 - 5 percen keresztül, a teljes mennyiségtől függően és az Ön kényelmének megfelelően, és 3 órán belül a feloldást követően fel kell használnia.
Hogyan kell a KOGENATE Bayer-t a beadáshoz előkészíteni
Kizárólag a készítmény minden egyes csomagjához mellékelt eszközöket (üveg adapter, oldószert és vénapunkciós készletet tartalmazó előretöltött fecskendő) használja. Ha ezek az eszközök nem használhatók, akkor kérjük, lépjen kapcsolatba kezelőorvosával. Ha a csomag bármelyik összetevőjét kinyitották vagy sérült, akkor ne használja.
Az oldatban esetlegesen előforduló részecskék eltávolítása céljából a feloldott készítményt az alkalmazás előtt át kell szűrnie! A szűrést az üveg adapter használatával végezheti el.
A beépített szűrő miatt a mellékelt vénapunkciós készletet tilos vérvételre használni!
Ez a gyógyszer nem keverhető más infúziós oldattal. Ne használja az oldatot, ha látható részecskéket tartalmaz vagy homályos. Kövesse a szigorúan a kezelőorvosa utasításait és alkalmazza a készítményt a részletes utasítások szerint a feloldásra és az injekció beadására , amelyet a betegtájékoztató végén talál.
Ha az előírtnál több KOGENATE Bayer készítményt alkalmazott
A rekombináns VIII. véralvadási faktor túladagolásával kapcsolatos esetekről nem számoltak be. Ha az előírtnál több KOGENATE Bayer készítményt alkalmazott, értesítse kezelőorvosát.
Ha elfelejtette alkalmazni a KOGENATE Bayer készítményt
- Azonnal folytassa a következő adagjával, és a továbbiakban alkalmazza az orvosa által meghatározott szabályos időközönként.
- Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására.
Ha idő előtt abba kívánja hagyni a KOGENATE Bayer alkalmazását
Ne hagyja abba a KOGENATE Bayer alkalmazását orvosa megkérdezése nélkül.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A legsúlyosabb mellékhatások a túlérzékenységi reakciók, illetve az anafilaxiás sokk (ritka mellékhatás).
Amennyiben allergiás vagy anafilaxiás reakció fordul elő, az injekció/infúzió beadását azonnal le kell állítani. Kérjük, azonnal forduljon kezelőorvosához.
A VIII as faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül többi mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
További lehetséges mellékhatások:
Gyakori (10 betegből legfeljebb 1 betegnél jelentkezik)
- kiütés/viszkető kiütés
- helyi reakciók ott, ahol beadta az injekciót (pl. égető érzés, átmeneti bőrpír)
Ritka (1000 betegből legfeljebb 1 betegnél jelentkezik)
- túlérzékenységi reakciók, beleértve a súlyos, hirtelen jelentkező allergiás reakciót (amelybe beletartozhat a hányinger, csalánkiütés, angioödéma, hidegrázás, kipirulás, fejfájás, letargia, sípoló légzés vagy légzési nehézség, nyugtalanság, szapora szívműködés, bizsergés vagy anafilaxiás sokk, pl. mellkasi szorító érzés/általános rossz közérzet, szédülés és émelygés, valamint enyhe vérnyomáscsökkenés, ami miatt álló helyzetben ájulásközeli érzést tapasztalhat)
- láz.
Nem ismert (a gyakoriság a rendelkezésra álló adatokból nem állapítható meg)
- az ízérzékelés zavara (különös íz)
Amennyiben injekció/infúzió közben az alábbi tünetek bármelyikét tapasztalja:
- mellkasi szorító érzés/általános rossz közérzet
- szédülés
- enyhe vérnyomáscsökkenés (amely miatt álló helyzetben ájulásközeli érzést tapasztalhat)
- émelygés
az túlérzékenység vagy anafilaktikus reakció előjele lehet.
Ha allergiás vagy anafilaktikus reakciók lépnek fel, azonnal szüntesse meg az injekció vagy infúzió adását. Azonnal forduljon orvoshoz.
Túlérzékenységi reakciók
A klinikai vizsgálatok során egy betegnél sem jelent meg klinikailag jelentős mennyiségű ellenanyag a készítményben nyomokban jelen levő egér- és hörcsögfehérjével szemben. A gyógyszerben található anyagokkal, pl. a nyomokban jelen levő egér- és hörcsögfehérjével szembeni allergiás reakció lehetősége az erre hajlamos betegek esetében fennáll.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a KOGENATE Bayer 3000 NE készítményt tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Hűtőszekrényben (2 °C-8 °C) tárolandó. Nem fagyasztható! A fénytől való védelem érdekében az injekciós üveget és az előretöltött fecskendőt tartsa a dobozában.
A címkén jelzett lejárati időn belül, a külső csomagolásban tárolt gyógyszer szobahőmérsékleten (legfeljebb 25 °C) korlátozott ideig, 12 hónapig tárolható. Ebben az esetben a 12 hónap leteltekor, vagy a gyógyszer injekciós üvegén lévő lejárati dátummal, amelyik előbb következik, a gyógyszer felhasználhatósági időtartama véget ér. Az új lejárati dátumot fel kell tüntetni a külső csomagoláson.
Feloldás után hűtőszekrényben nem tárolható. A feloldott készítményt 3 órán belül fel kell használni. A készítmény egy alkalommal használható fel. A fel nem használt oldat hulladékként kezelendő.
A csomagoláson és a címkén feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Ne alkalmazza ezt a gyógyszert, ha látható részecskéket tartalmaz vagy zavaros.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a KOGENATE Bayer készítmény
Por
A készítmény hatóanyaga a rekombináns DNS-technológiával előállított
VIII. humán véralvadási faktor (alfa-oktokog). Minden üveg KOGENATE Bayer 250, 500, 1000, 2000 vagy 3000 NE oktogon alfát tartalmaz.
Egyéb összetevők: glicin, nátrium-klorid, kalcium-klorid, hisztidin, poliszorbát 80 és szacharóz (lásd a 2. pont végét).
Oldószer
Injekcióhoz való víz, sterilizált.
Milyen a KOGENATE Bayer külleme és mit tartalmaz a csomagolás
A KOGENATE Bayer készítmény kiszerelése: fehér vagy enyhén sárga színű por vagy pogácsa és oldószer oldatos injekcióhoz. Az előretöltött fecskendő injekcióhoz való vízet tartalmaz az üveg tartalmának a feloldáshoz.Feloldás után az oldat tiszta. A KOGENATE Bayer készítmény minden egyes csomagja tartalmazza a feloldáshoz és beadáshoz szükséges orvosi eszközöket.
Minden csomag KOGENATE Bayer tartalmaz egy injekciós üveget és egy előretöltött fecskendőt külön dugattyúval, valamint vénapunkciós készletet (a vénába történő injekciózáshoz), két alkoholos törlőt, két száraz törlőt és két ragtapaszt.
Részletes utasítások KOGENATE Bayer feloldásra és az injekció beadására injekciós üveg és üveg adapter esetén
A KOGENATE Bayer rekombináns humán VIII. véralvadási faktor hatóanyagot (alfa-oktokogot) tartalmaz.
A KOGENATE Bayer vérzés kezelésére vagy megelőzésére ajánlott A-típusú hemofília (a VIII. faktor örökletes hiánya) esetén felnőtteknek, serdülőknek és bármely korosztályba tartozó gyermekeknek.
A készítmény nem tartalmaz von Willebrand-faktort, ezért von Willebrand-betegség esetén nem alkalmazható.
2. Tudnivalók KOGENATE Bayer alkalmazása előtt
Ne alkalmazza a KOGENATE Bayer készítményt,
- ha allergiás az alfa-oktokogra vagy a gyógyszer (6. pontban és a 2. pont végén felsorolt) egyéb összetevőjére.
- ha allergiás az egér- vagy hörcsögfehérjére.
Ha nem biztos benne, kérdezze meg erről kezelőorvosát.
Figyelmeztetések és óvintézkedések
A KOGENATE Bayerfokozott elővigyázatossággal, alkalmazható, és beszéljen kezelőorvosával vagy gyógyszerészével, ha:
- mellkasi szorító érzést, szédülést tapasztal, rosszul érzi magát, hirtelen elgyengül vagy állva szédül, lehet, hogy ritka, súlyos, hirtelen fellépő allergiás reakciót tapasztal (az úgynevezett anafilaxiás reakciót) erre a gyógyszerre. Ha ezeket a tüneteket észleli, azonnal hagyja abba a készítmény alkalmazását, és forduljon orvoshoz.
- Előfordulhat, hogy orvosa vizsgálatokat végezhet el annak megállapítására, hogy a gyógyszer alkalmazott adagja biztosítja-e a VIII. faktor megfelelő vérszintjét.
- a vérzése a gyógyszer általában alkalmazott adagjával nem szüntethető meg Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem állítható el Önnél, illetve gyermekénél a KOGENATE Bayer készítménnyel, azonnal tájékoztassa erről kezelőorvosát.
- Önnél korábban VIII. faktor inhibitor alakult ki, és más VIII. faktor készítményre vált, akkor fennáll a kockázata annak, hogy ez az inhibitor ismét megjelenik.
- korábban azt mondták Önnek, hogy szívbetegségben szenved, vagy szívbetegség kockázata áll fenn Önnél, tájékoztassa kezelőorvosát vagy gyógyszerészét.
- a KOGENATE Bayer beadásához Önnél egy centrális vénás kanülre van szükség. A centrális vénás kanüllel kapcsolatos szövődmények kockázata állhat fenn, beleértve a helyi fertőzéseket, a baktériumok véráramba kerülését (bakterémia), valamint a kanül bevezetésének helyén az érben kialakó vérrögöt (trombózis).
Előfordulhat, hogy orvosa vizsgálatokat végezhet el annak megállapítására, hogy a gyógyszer alkalmazott adagja biztosítja-e a VIII. faktor megfelelő vérszintjét.
Egyéb gyógyszerek és a KOGENATE Bayer
Bár más gyógyszerkészítménnyel való kölcsönhatás nem ismert, feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, szedni tervezett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Gyermekek és serdülők
A felsorolt figyelmeztetések és óvintézkedésekminden életkorú felnőttre és gyermekre vonatkoznak.
Terhesség, szoptatás és termékenység
A KOGENATE Bayer terhesség és szoptatás alatti használatával, valamint a termékenységre kifejtett hatásával kapcsolatban nincsenek tapasztalatok. Ezért, ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége, vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
KOGENATE Bayer nincs hatással a férfi vagy női termékenységre, mivel a hatóanyaga a testben természetes módon jelen van.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
A készítménynek a gépjárművezetéshez és gépek kezeléséhez szükséges képességeket befolyásoló hatását nem észlelték.
A KOGENATE Bayer nátriumot tartalmaz
A készítmény kevesebb mint 1 mml (23 mg) nátriumot tartalmaz injekciós üvegenként, azaz gyakorlatilag nátriummentes.
Nyilvántartás
Javasolt, hogy minden alkalommal, amikor Ön KOGENATE Bayer -t alkalmaz, jegyezze fel a készítmény nevét és gyártási számát.
3. Hogyan kell alkalmazni a KOGENATE Bayer készítményt?
Ezt a gyógyszert mindig pontosan a betegtájékoztatóban leírtaknak, vagy az Ön kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát, gyógyszerészét vagy a nővért.
Vérzés kezelése
Orvosa ki fogja számítani a gyógyszer adagját és azt, hogy milyen gyakran kell alkalmaznia, hogy elérje a szükséges VIII. faktor aktivitási szintet a vérében. A gyógyszer alkalmazott mennyiségét és adagolási gyakoriságát orvosa mindig az Ön egyéni szükségleteinek megfelelően állítja be. Azt, hogy mennyi KOGENATE Bayer-t kell alkalmaznia és milyen gyakorisággal kell használnia több tényező befolyásolja, mint például:
- az Ön testtömege
- az Ön hemofíliájának súlyossága
- a vérzés helye és súlyossága
- az inhibitorok megléte és mennyisége és milyen magas a titráció
- a szükséges VIII. faktor szint
Vérzés megelőzése
Ha a KOGENATE Bayer-t a vérzés megelőzésére használja (profilaxis), orvosa kiszámítja az Önnek megfelelő adagot. Ez általában testtömeg-kilogrammonként 20-40 NE alfa-oktokog, minden 2.-3. napon adva. Azonban egyes esetekben, különösen fiatal betegeknél, rövidebb adagolási időközök vagy magasabb adagok adása válhatnak szükségessé.
Laboratóriumi vizsgálatok
Hangsúlyozottan ajánlott a plazma megfelelő időközönkénti laboratóriumi vizsgálatának elvégzése annak ellenőrzésére, hogy sikerült-e elérni és fenntartani a szükséges VIII. faktor aktivitási szintet. Különösen nagyobb műtéteknél szükséges a faktorpótló terápia véralvadási vizsgálattal történő pontos monitorozása.
Gyermekek és serdülők
A KOGENATE Bayer bármilyen életkorú gyermekenél alkalmazható.
Ha a vérzés nem állítható el
Amennyiben a VIII. faktor várt aktivitási szintjét a plazmában nem sikerül elérni, vagy ha a vérzés a nyilvánvalóan megfelelő adaggal nem állítható el, előfordulhat, hogy a vérében VIII. faktor inhibitor van jelen. Ezt egy abban jártas szakembernek ellenőriznie kell.
Ha ezen gyógyszer alkalmazása során annak hatását túlzottan erősnek, vagy csekélynek érzi, forduljon orvosához vagy gyógyszerészéhez.
Inhibitorok jelenléte
Ha orvosa azt mondta Önnek, hogy vérében VIII. faktor inhibitorok alakultak ki, akkor előfordulhat, hogy nagyobb mennyiségű gyógyszert kell használnia a vérzés csillapítására. Amennyiben ez az adag nem szünteti hatásosan a vérzést, orvosa a kezelést kiegészítő készítmény - VIIa faktor koncentrátum vagy (aktivált) protrombin komplex koncentrátum - adása mellett dönthet.
Az ilyen kezeléseket az A-típusú haemophilia kezelésében tapasztalt orvos írhatja elő. További információért forduljon orvosához.
Az orvosával történő egyeztetés nélkül ne növelje a vérzés csillapítására használt gyógyszer adagját.
A beadás sebessége
Ezt a gyógyszert intravénásan kell beadni több perces időtartam alatt. A beadás sebességét a beteg komfortérzése határozza meg (maximális injektálási sebesség: 2 ml/perc).
A kezelés időtartama
Orvosa megmondja Önnek, hogy ezt a gyógyszert milyen gyakran, milyen időközönként kell használnia.A KOGENATE Bayer készítménnyel végzett faktorpótló terápia általában élethosszig tart.
Hogyan kell beadni a Kogenate Bayer-t
Ez a gyógyszert a vénába kell beadni injekció formájában, 2 - 5 percen keresztül, a teljes mennyiségtől függően és az Ön kényelmének megfelelően, és 3 órán belül a feloldást követően fel kell használnia.
Hogyan kell a KOGENATE Bayer-t a beadáshoz előkészíteni
Kizárólag a készítmény minden egyes csomagjához mellékelt eszközöket (üveg adapter, oldószert és vénapunkciós készletet tartalmazó előretöltött fecskendő) használja. Ha ezek az eszközök nem használhatók, akkor kérjük, lépjen kapcsolatba kezelőorvosával. Ha a csomag bármelyik összetevőjét kinyitották vagy sérült, akkor ne használja.
Az oldatban esetlegesen előforduló részecskék eltávolítása céljából a feloldott készítményt az alkalmazás előtt át kell szűrnie! A szűrést az üveg adapter használatával végezheti el.
A beépített szűrő miatt a mellékelt vénapunkciós készletet tilos vérvételre használni!
Ez a gyógyszer nem keverhető más infúziós oldattal. Ne használja az oldatot, ha látható részecskéket tartalmaz vagy homályos. Kövesse a szigorúan a kezelőorvosa utasításait és alkalmazza a készítményt a részletes utasítások szerint a feloldásra és az injekció beadására , amelyet a betegtájékoztató végén talál.
Ha az előírtnál több KOGENATE Bayer készítményt alkalmazott
A rekombináns VIII. véralvadási faktor túladagolásával kapcsolatos esetekről nem számoltak be. Ha az előírtnál több KOGENATE Bayer készítményt alkalmazott, értesítse kezelőorvosát.
Ha elfelejtette alkalmazni a KOGENATE Bayer készítményt
- Azonnal folytassa a következő adagjával, és a továbbiakban alkalmazza az orvosa által meghatározott szabályos időközönként.
- Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására.
Ha idő előtt abba kívánja hagyni a KOGENATE Bayer alkalmazását
Ne hagyja abba a KOGENATE Bayer alkalmazását orvosa megkérdezése nélkül.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A legsúlyosabb mellékhatások a túlérzékenységi reakciók, illetve az anafilaxiás sokk (ritka mellékhatás).
Amennyiben allergiás vagy anafilaxiás reakció fordul elő, az injekció/infúzió beadását azonnal le kell állítani. Kérjük, azonnal forduljon kezelőorvosához.
A VIII as faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül többi mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
További lehetséges mellékhatások:
Gyakori (10 betegből legfeljebb 1 betegnél jelentkezik)
- kiütés/viszkető kiütés
- helyi reakciók ott, ahol beadta az injekciót (pl. égető érzés, átmeneti bőrpír)
Ritka (1000 betegből legfeljebb 1 betegnél jelentkezik)
- túlérzékenységi reakciók, beleértve a súlyos, hirtelen jelentkező allergiás reakciót (amelybe beletartozhat a hányinger, csalánkiütés, angioödéma, hidegrázás, kipirulás, fejfájás, letargia, sípoló légzés vagy légzési nehézség, nyugtalanság, szapora szívműködés, bizsergés vagy anafilaxiás sokk, pl. mellkasi szorító érzés/általános rossz közérzet, szédülés és émelygés, valamint enyhe vérnyomáscsökkenés, ami miatt álló helyzetben ájulásközeli érzést tapasztalhat)
- láz.
Nem ismert (a gyakoriság a rendelkezésra álló adatokból nem állapítható meg)
- az ízérzékelés zavara (különös íz)
Amennyiben injekció/infúzió közben az alábbi tünetek bármelyikét tapasztalja:
- mellkasi szorító érzés/általános rossz közérzet
- szédülés
- enyhe vérnyomáscsökkenés (amely miatt álló helyzetben ájulásközeli érzést tapasztalhat)
- émelygés
az túlérzékenység vagy anafilaktikus reakció előjele lehet.
Ha allergiás vagy anafilaktikus reakciók lépnek fel, azonnal szüntesse meg az injekció vagy infúzió adását. Azonnal forduljon orvoshoz.
Túlérzékenységi reakciók
A klinikai vizsgálatok során egy betegnél sem jelent meg klinikailag jelentős mennyiségű ellenanyag a készítményben nyomokban jelen levő egér- és hörcsögfehérjével szemben. A gyógyszerben található anyagokkal, pl. a nyomokban jelen levő egér- és hörcsögfehérjével szembeni allergiás reakció lehetősége az erre hajlamos betegek esetében fennáll.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a KOGENATE Bayer 3000 NE készítményt tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Hűtőszekrényben (2 °C-8 °C) tárolandó. Nem fagyasztható! A fénytől való védelem érdekében az injekciós üveget és az előretöltött fecskendőt tartsa a dobozában.
A címkén jelzett lejárati időn belül, a külső csomagolásban tárolt gyógyszer szobahőmérsékleten (legfeljebb 25 °C) korlátozott ideig, 12 hónapig tárolható. Ebben az esetben a 12 hónap leteltekor, vagy a gyógyszer injekciós üvegén lévő lejárati dátummal, amelyik előbb következik, a gyógyszer felhasználhatósági időtartama véget ér. Az új lejárati dátumot fel kell tüntetni a külső csomagoláson.
Feloldás után hűtőszekrényben nem tárolható. A feloldott készítményt 3 órán belül fel kell használni. A készítmény egy alkalommal használható fel. A fel nem használt oldat hulladékként kezelendő.
A csomagoláson és a címkén feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Ne alkalmazza ezt a gyógyszert, ha látható részecskéket tartalmaz vagy zavaros.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a KOGENATE Bayer készítmény
Por
A készítmény hatóanyaga a rekombináns DNS-technológiával előállított
VIII. humán véralvadási faktor (alfa-oktokog). Minden üveg KOGENATE Bayer 250, 500, 1000, 2000 vagy 3000 NE oktogon alfát tartalmaz.
Egyéb összetevők: glicin, nátrium-klorid, kalcium-klorid, hisztidin, poliszorbát 80 és szacharóz (lásd a 2. pont végét).
Oldószer
Injekcióhoz való víz, sterilizált.
Milyen a KOGENATE Bayer külleme és mit tartalmaz a csomagolás
A KOGENATE Bayer készítmény kiszerelése: fehér vagy enyhén sárga színű por vagy pogácsa és oldószer oldatos injekcióhoz. Az előretöltött fecskendő injekcióhoz való vízet tartalmaz az üveg tartalmának a feloldáshoz.Feloldás után az oldat tiszta. A KOGENATE Bayer készítmény minden egyes csomagja tartalmazza a feloldáshoz és beadáshoz szükséges orvosi eszközöket.
Minden csomag KOGENATE Bayer tartalmaz egy injekciós üveget és egy előretöltött fecskendőt külön dugattyúval, valamint vénapunkciós készletet (a vénába történő injekciózáshoz), két alkoholos törlőt, két száraz törlőt és két ragtapaszt.
Részletes utasítások KOGENATE Bayer feloldásra és az injekció beadására injekciós üveg és üveg adapter esetén


 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026


















