
OCTANATE 1000 NE por és oldószer oldatos injekcióhoz
ATC
VIII koagulációs faktor
Hatóanyag
factor VIII
OCTANATE 1000 NE por és oldószer oldatos injekcióhoz betegtájékoztatója
1. Milyen típusú gyógyszer az Octanate injekció és milyen betegségek esetén alkalmazható?
Az Octanate a humán VIII. koagulációs faktort tartalmazza por alakban, valamint injekcióhoz való vizet. A mellékelt oldószerben való feloldás után az Octanate intravénásan alkalmazandó.
Az Octanate-t a vérzés kezelésére és megelőzésére alkalmazzák az alábbi betegségekben szenvedő betegek esetében:
- hemofília A (örökletes, vagyis születéstől fennálló VIII. faktor hiány),
- szerzett VIII. faktor hiány,
- a VIII. faktor ellen termelődő antitestek (inhibitorok) által kiváltott hemofília.
2. Tudnivalók az Octanate injekció alkalmazása előtt
Erősen javasolt, hogy minden alkalommal, amikor Octanate-et kap, akkor a termék nevét és tételszámát jegyezzék fel, hogy rögzítve legyen a felhasznált tétel száma.
Ha rendszeresen vagy gyakran kap emberi eredetű VIII-as faktor készítményt, akkor kezelőrovosa javasolhatja, hogy oltassa be magát hepatitisz A és B ellen.
Ne alkalmazza az Octanate-et:
- ha allergiás az emberi VIII-as véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
Figyelmeztetések és óvintézkedések
Az Octanate alkalmazása előtt beszéljen kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel.
Az Octanate nagyon kis mennyiségben más emberi eredetű fehérjéket is tartalmaz. Mint minden vénába adott (intravénásan alkalmazott) fehérjét tartalmazó terméknél, előfordulhatnak allergiás reakciók (lásd 4. pont, Lehetséges mellékhatások).
Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert szövődmény, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem állítható el Önnél, illetve gyermekénél az Octanate -tel, azonnal tájékoztassa erről kezelőorvosát.
Az Octanate előállításához használt vérre és plazmára vonatkozó információk
Humán vérből vagy plazmából készült gyógyszerek előállítása esetén bizonyos lépéseket alkalmaznak a fertőzések átvitelének megakadályozása érdekében. Ilyen például a vér- és plazmadonorok gondos kiválasztása, a fertőzések szempontjából kockázatosnak ítélt személyek kizárása, az egyes levett vérek és az összeöntött plazma szűrése a vírusok/fertőzések szempontjából. Az ilyen termékek gyártói a vér és a plazma feldolgozási folyamataiba is beépítenek a vírusokat inaktiváló vagy eltávolító lépéseket. Mindezek ellenére az emberi plazmából vagy vérből készített orvosi készítmények alkalmazása esetén a fertőző ágensek átviteléből származó fertőző betegségek kockázata nem zárható ki teljes mértékben. Ez a még ismeretlen kórokozó ágensekre is vonatkozik.
Az elvégzett lépések hatékonynak tekinthetők a burokkal rendelkező vírusokkal, például a humán immundeficiencia vírussal (HIV-vel), a hepatitis B vírussal (HBV-vel) és a hepatitis C vírussal (HCV-vel), valamint a burokkal nem rendelkező hepatitis A vírussal (HAV-val) szemben. A vírus inaktiváló / eltávolító eljárás csak korlátozott hatással van az olyan burokkal nem rendelkező vírusok esetében, mint amilyen a parvovírus B19.
A parvovírus B19 terhesekben súlyos (magzati) fertőzést, immunhiányos vagy vérszegénységben (például sarlósejtes vérszegénységben vagy a vörösvértestek kóros lebomlási folyamatában) szenvedő betegekben súlyos fertőzést okozhat.
Egyéb gyógyszerek és az Octanate
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett vagy szedni tervezett egyéb gyógyszereiről beleértve a recept nélkül kapható készítményeket is.
A humán VIII-as véralvadási faktor termékek más gyógyszerkészítményekkel való interakciója nem ismert. Az Octanate azonban nem adható semmilyen más gyógyszerrel együtt egy infúzióban.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A gépjárművezetéséhez és a gépek kezeléséhez szükséges képességekre gyakorolt hatást nem figyeltek meg.
Az Octanate nátriumot tartalmaz
A készítmény kevesebb, mint 23 mg nátriumot tartalmaz Octanate 250 NE/injekciós, azaz gyakorlatilag "nátriummentes".
Ez a gyógyszer legfeljebb 40 mg nátriumot (a konyhasó fő összetevője) tartalmaz Octanate 500 és 1000 NE/injekciós , ami megfelel a nátrium ajánlott maximális napi bevitel 2%-ának felnőtteknél.
Ezt kontrollált nátrium diéta esetén figyelembe kell venni.
3. Hogyan kell alkalmazni az Octanate injekciót?
Az Octanate-et a mellékelt oldószerrel történő feloldás után intravénás injekció formájában kell beadni.
A kezelést orvos felügyelete alatt kell megkezdeni.
Adagolás a vérzés megelőzésére Amennyiben súlyos hemofília A-ban szenved, akkor a hosszú távú megelőzés érdekében két-három naponta testsúlykilogrammonként 20-40 NE faktort kell beadni. Az adag a válasz függvényében módosítható. Bizonyos esetekben nagyobb gyakoriságra vagy nagyobb adagra lehet szükség.
Adagolás számítása
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
A VIII-as faktor aktivitása a plazmában jelenlévő VIII-as faktor mennyiségére utal. A plazma VIII. faktor aktivitást százalékban (a normál emberi plazmához viszonyítva), vagy nemzetközi egységben (a plazma VIII. faktorra vonatkozó nemzetközi szabványhoz viszonyítva) fejezik ki. A VIII-as faktor adagját NE-ben fejezik ki.
Egy nemzetközi egységnyi (NE) VIII-as faktoraktivitás a normál emberi plazma 1 ml-ében lévő VIII-as faktor mennyiségének felel meg. 1 NE VIII-as faktor/ttkg a plazma VIII-as faktor aktivitását 1,5-2%-kal emeli. A szükséges dózis kiszámításához meghatározzák vérplazmájában a VIII. faktor aktivitást, valamint, hogy mennyivel kell ezt a szintet növelni. Amennyiben nem biztos az adag kiszámítási módjában vagy nem tudja, hogy mennyivel kell emelni a VIII-as faktor aktivitást, kérjük forduljon kezelőorvosához.
A szükséges adagot (NE) a következő képlettel lehet meghatározni:
Szükséges adag (NE) = testtömeg (kg) × a kívánt VIII-as faktoraktivitás-emelkedés (%) (NE/dl) × 0,5
A szükséges mennyiséget és a kezelés gyakoriságát mindig az egyedi esetben elért klinikai hatékonyságra való tekintettel kell meghatározni.
Az alábbi vérzéses epizódok esetén a megfelelő időtartam során a VIII-as faktoraktivitás szintje nem süllyedhet a megadott értékek alá (a normál érték százalékában).
A következő táblázat útmutatóként használható vérzéses epizódok és sebészeti beavatkozások során:
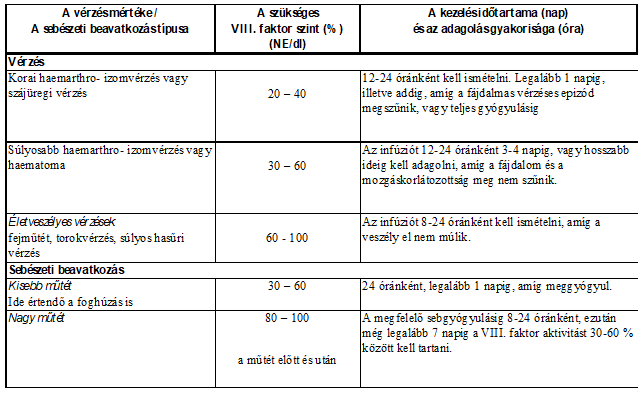
Kezelőorvosa fogja előírni Önnek az Octanate adagját és az adagolási gyakoriságot.
A VIII-as faktorra adott reakciója változó lehet, ezért a VIII-as faktor vérszintjét a kezelés során mérni kell, és ennek alapján kell meghatározni a pontos adagot és az infúzió gyakoriságát.
Egyes esetekben, elsősorban a kezdő adagra vonatkozóan, a számítottnál nagyobb mennyiségre lehet szükség.
A betegek eltérően reagálhatnak a VIII-as faktorra, eltérő in vivo hasznosulási szintet érhetnek el és különbség lehet a plazma-féléletidőben is.
A szubsztitúciós kezelés véralvadási vizsgálatokkal történő (a plazma VIII-as faktoraktivitásának) gondos nyomonkövetése - elsősorban a nagyobb sebészeti beavatkozások után - elengedhetetlen.
Vérzés megelőzése: A súlyos haemophilia-A-ban szenvedő betegeknél a vérzések hosszú távú megelőzésére 20-40 VIII-as faktor/ttkg adagot kell alkalmazni 2-3 napos intervallumokban. Egyes esetekben, főleg fiatal betegeknél, rövidebb intervallumokra vagy nagyobb adagokra lehet szükség.
Inhibitorok: A humán VIII-as koagulációs faktorral kezelt betegek esetében figyelemmel kell kísérni a gátló (inhibitor) antitestek termelődését. Ha a várt VIII. faktor szintet nem sikerül elérni, illetve ha a vérzés nem vonható kontroll alá a megfelelő adaggal, meg kell vizsgálni, nincs-e jelen a beteg szervezetében VIII. faktort gátló inhibitor. Ha az inhibitor szintje alacsonyabb, mint 10 Bethesda Egység (Bethesda Unit, BU)/ml, további VIII. humán koagulációs faktor adagolásával az inhibitor semlegesíthető. 10 BU feletti inhibitor titer esetén meg kell fontolni (aktivált) protrombin komplex koncentrátum (prothrombin complex concentrate, PCC) vagy rekombináns aktivált VII. faktor (rFVIIa) készítmények alkalmazását. Ezeket a kezeléseket hemofíliás betegek kezelésében jártas orvos irányítása alatt kell végezni.
Alkalmazása gyermekeknél
Klinikai vizságlatok során nem állapítottak meg speciálisan gyermekekre vonatkozó adagolási előírásokat. Az adagolás kezelés és megelőzés esetén is megegyezik a felnőtt adagolással.
Otthoni kezelésre vonatkozó utasítások
- Kérjük, gondosan olvassa el az utasításokat, és pontosan kövesse azokat!
- A címkén feltüntetett lejárati idő után ne alkalmazza a Octanate-t.
- A feloldott gyógyszerkészítményt vizuálisan vizsgálja meg, hogy tartalmaz-e szemcsés anyagot vagy elszíneződést.
- Az alább részletezett eljárás során a sterilitást mindvégig fenn kell tartani!
- Az oldatnak átlátszónak vagy opálosnak kell lennie. Ne használja az oldatot ha zavaros vagy csapadék látható benne.
- A mikrobák általi szennyeződés elkerülése érdekében azonnal használja fel az elkészített oldatot.
- Kizárólag a mellékelt infúziós készletet alkalmazza. Más injekciós/infúziós eszközök alkalmazása további kockázatokhoz és a kezelés sikertelenségéhez vezethet.
Utasítások az oldat elkészítéséhez:
1. Ne alkalmazza a készítményt közvetlenül azután, hogy kivette a hűtőszekrényből. Hagyja, hogy a zárt üvegekben lévő oldószer és por szobahőmérsékletűre melegedjenek.
2. Távolítsa el a port és az oldószert tartalmazó üvegek lepattintható kupakját, majd az egyik mellékelt alkoholos törlővel tisztítsa meg a gumidugókat.
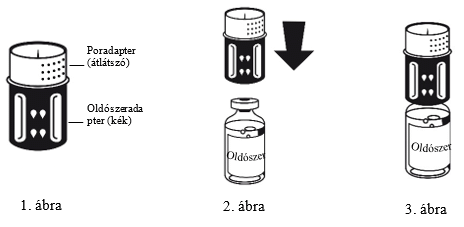
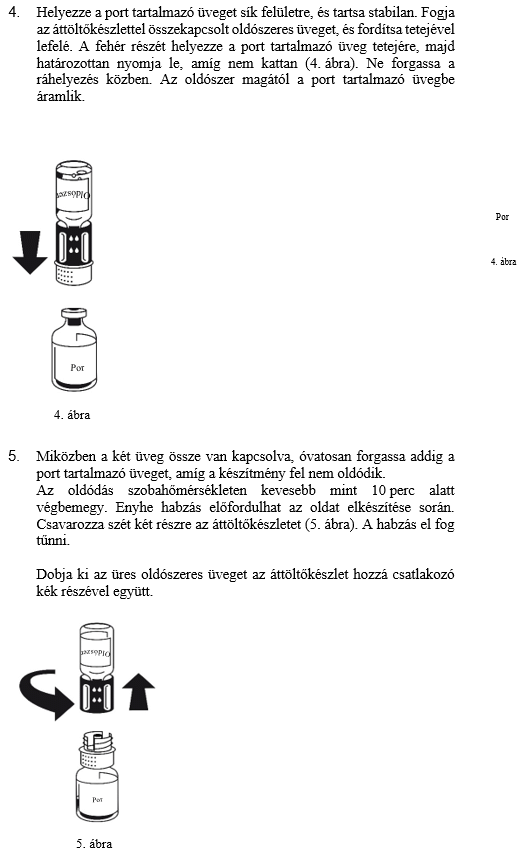
3. Az áttöltőkészlet az 1. ábrán látható. Helyezze az oldószert tartalmazó üveget sík felületre, és tartsa stabilan. Fogja az áttöltőkészletet, és fordítsa tetejével lefelé. Az áttöltőkészlet kék részét helyezze az oldószeres üveg tetejére, majd határozottan nyomja le, amíg nem kattan (2. és 3. ábra). Ne forgassa a ráhelyezés közben.
Utasítások az injekció beadásához:
A biztonság kedvéért a pulzusát a befecskendezés előtt és annak folyamán mérni kell. Ha a pulzus észrevehetően emelkedik, akkor a befecskendezés sebességét le kell lassítani, vagy a beadást rövid ideig meg kell szakítani.
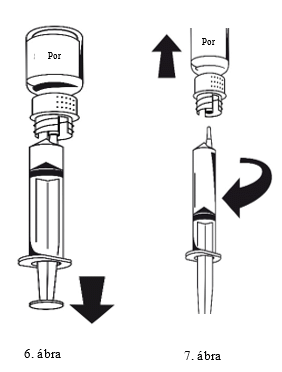
1. Csatlakoztassa a fecskendőt az áttöltőkészlet fehér részéhez. Fordítsa az injekciós üveget tetejével lefelé, és szívjon oldatot a fecskendőbe (6. ábra).
A fecskendőben lévő oldatnak átlátszónak vagy enyhén opálosnak kell lennie. Ha az oldat átkerült a fecskendőbe, akkor tartsa stabilan a fecskendő dugattyúját (úgy, hogy az lefelé nézzen), majd távolítsa el a fecskendőt az áttöltőkészletről (7. ábra).
Dobja ki az üres üveget az áttöltőkészlet fehér részével együtt.
2. Az egyik mellékelt alkoholos törlő segítségével tisztítsa meg a megszúrandó bőrfelületet.
3. Csatlakoztassa a mellékelt infúziósszereléket a fecskendőhöz.
4. Szúrja az injekciós tűt a kiválasztott vénába. Amennyiben leszorítást alkalmazott a véna jobb észlelhetősége céljából, akkor ezt a leszorítást a Octanate beadása előtt fel kell engedni.
5. A fibrinalvadékok képződésének veszélye miatt nem szabad hagyni, hogy a vér visszafolyjon a fecskendőbe.
6. Lassan fecskendezze be a vénába, nem gyorsabban mint 2-3 ml/perc.
Ha Ön egynél több injekciós üvegnyi Octanate port alkalmaz, akkor használhatja ugyanezt az injekciós tűt és fecskendőt. Az áttöltőkészlet csak egyszer használatos.
Bármilyen fel nem használt termék, illetve hulladékanyag megsemmisítését a gyógyszerekre vonatkozó előírások szerint kell végrehajtani.
Ha az előírtnál több Octanate injekciót kapott:
Nem jegyeztek a humán VIII-as koagulációs faktor túladagolásával kapcsolatos tüneteket. A javasolt adagot azonban nem szabad túllépni.
Ha elfelejtették alkalmazni az Octanate injekciót:
Ne adjon be kétszeres adagot a kihagyott adag pótlására. Azonnal adja be a következő adagot és folytassa a kezelést a kezelőorvos vagy a gyógyszerész útmutatásai szerint.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ritkán (1000-ből legfeljebb 1 embert érinthet) megfigyeltek túlérzékenységet vagy allergiás reakciókat a VIII-as faktor tartalmú készítményekkel kezelt betegek körében.
Az alábbi tünetek jelentkezése esetén forduljon kezelőorvosához:
hányás, az infúziós területen égető vagy szúró érzés, mellkasi nyomásérzés, hidegrázás, felgyorsult szívverés (tachikardia), hányinger, bizsergés, kivörösödés, fejfájás, csalánikütés, alacsony vérnyomás, kiütés, nyugtalanság, az arc, az ajak, a száj, a nyelv vagy a torok nyelési vagy légzési nehézséget okozó duzzanata (angioödéma), fáradtság (letargia), zihálás.
Nagyon ritkán (10 000-ből legfeljebb 1 embert érinthet) a túlérzékenység súlyos, életveszélyes allergiás reakciót, úgynevezett anafilaxist okozhat, amelynek során sokk, illetve a fenti tünetek bármelyike vagy akár az összes jelentkezhet. Ebben az esetben azonnal keresse fel orvosát vagy hívjon mentőt.
Egyéb ritka mellékhatások (1000-ből legfeljebb 1 embert érinthet)
Ritka esetekben lázat is megfigyeltek.
A VIII-as faktor készítménnyel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1 esetben) inhibitor ellenanyagok (gátló hatású antitestek) jelenhetnek meg (lásd 2. pont); a VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél a kockázat nem gyakori(100 beteg közül kevesebb mint 1 esetben). Ha bekövetkezik ez a szövődmény, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
A vírusbiztonságosságra vonatkozó információt lásd a 2. pontban. (Figyelmeztetések és óvintézkedések - Az Octanate előállításához használt vérre és plazmára vonatkozó információk).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell az Octanate injekciót tárolni?
2 °C és 25 °C között, fénytől védve tárolandó.
Nem fagyasztható.
A gyógyszer gyermekektől elzárva tartandó!
A címkén feltüntetett lejárati idő után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Az elkészített oldatot azonnal fel kell használni és csak egyszeri használatra szolgál.
Ne alkalmazza a gyógyszert, ha zavaros vagy a por nem oldódott fel teljes mértékben.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz az Octanate?
A készítmény hatóanyaga: Humán koagulációs VIII. faktor, fagyasztással szárítva.
Porampulla:
Octanate 25: 250 Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max. 5mg
Octanate 500: 500 Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max 11 mg
Octanate 1000: 1000 Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max 22 mg
Egyéb összetevők: nátrium-citrát, nátrium klorid, kalcium-klorid, glicin.
Oldószert tartalmazó injekciós üveg:
Injekcióhoz való víz
Az Octanate nem tartalmaz antimikrobiális vagy tartósító szereket.
Leírás: Injekció: fehér vagy halványsárga színű, liofilezett, steril por + oldószer (színtelen, tiszta steril injekcióhoz való víz)
Milyen az Octanate külleme és mit tartalmaz a csomagolás?
Csomagolás:
Porampulla: liofilezett por, halobutil gumidugóval, rollnizott alumíniumkupakkal és lepattintható műanyag fedéllel lezárt színtelen injekciós üvegbe (I. típusú) töltve.
Oldószert tartalmazó injekciós üveg:
5 (Octanate 250), 10 (Octanate 500, Octanate 1000) színtelen, tiszta steril injekcióhoz való víz, halobutil gumidugóval, rollnizott alumíniumkupakkal és lepattintható műanyag fedéllel lezárt színtelen injekciós üvegbe töltve.
- 1db, az intravénás injekció alkalmazásához szükséges készlet (1 db áttöltőkészlet, 1 db infúziós szerelék és 1 db egyszer használatos fecskendő)
- 2 darab alkoholos törlő
Az Octanate műanyag fóliával összekapcsolt két dobozból álló kombinált csomagolásban kerül forgalomba.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
Az Octanate a humán VIII. koagulációs faktort tartalmazza por alakban, valamint injekcióhoz való vizet. A mellékelt oldószerben való feloldás után az Octanate intravénásan alkalmazandó.
Az Octanate-t a vérzés kezelésére és megelőzésére alkalmazzák az alábbi betegségekben szenvedő betegek esetében:
- hemofília A (örökletes, vagyis születéstől fennálló VIII. faktor hiány),
- szerzett VIII. faktor hiány,
- a VIII. faktor ellen termelődő antitestek (inhibitorok) által kiváltott hemofília.
2. Tudnivalók az Octanate injekció alkalmazása előtt
Erősen javasolt, hogy minden alkalommal, amikor Octanate-et kap, akkor a termék nevét és tételszámát jegyezzék fel, hogy rögzítve legyen a felhasznált tétel száma.
Ha rendszeresen vagy gyakran kap emberi eredetű VIII-as faktor készítményt, akkor kezelőrovosa javasolhatja, hogy oltassa be magát hepatitisz A és B ellen.
Ne alkalmazza az Octanate-et:
- ha allergiás az emberi VIII-as véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
Figyelmeztetések és óvintézkedések
Az Octanate alkalmazása előtt beszéljen kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel.
Az Octanate nagyon kis mennyiségben más emberi eredetű fehérjéket is tartalmaz. Mint minden vénába adott (intravénásan alkalmazott) fehérjét tartalmazó terméknél, előfordulhatnak allergiás reakciók (lásd 4. pont, Lehetséges mellékhatások).
Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert szövődmény, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem állítható el Önnél, illetve gyermekénél az Octanate -tel, azonnal tájékoztassa erről kezelőorvosát.
Az Octanate előállításához használt vérre és plazmára vonatkozó információk
Humán vérből vagy plazmából készült gyógyszerek előállítása esetén bizonyos lépéseket alkalmaznak a fertőzések átvitelének megakadályozása érdekében. Ilyen például a vér- és plazmadonorok gondos kiválasztása, a fertőzések szempontjából kockázatosnak ítélt személyek kizárása, az egyes levett vérek és az összeöntött plazma szűrése a vírusok/fertőzések szempontjából. Az ilyen termékek gyártói a vér és a plazma feldolgozási folyamataiba is beépítenek a vírusokat inaktiváló vagy eltávolító lépéseket. Mindezek ellenére az emberi plazmából vagy vérből készített orvosi készítmények alkalmazása esetén a fertőző ágensek átviteléből származó fertőző betegségek kockázata nem zárható ki teljes mértékben. Ez a még ismeretlen kórokozó ágensekre is vonatkozik.
Az elvégzett lépések hatékonynak tekinthetők a burokkal rendelkező vírusokkal, például a humán immundeficiencia vírussal (HIV-vel), a hepatitis B vírussal (HBV-vel) és a hepatitis C vírussal (HCV-vel), valamint a burokkal nem rendelkező hepatitis A vírussal (HAV-val) szemben. A vírus inaktiváló / eltávolító eljárás csak korlátozott hatással van az olyan burokkal nem rendelkező vírusok esetében, mint amilyen a parvovírus B19.
A parvovírus B19 terhesekben súlyos (magzati) fertőzést, immunhiányos vagy vérszegénységben (például sarlósejtes vérszegénységben vagy a vörösvértestek kóros lebomlási folyamatában) szenvedő betegekben súlyos fertőzést okozhat.
Egyéb gyógyszerek és az Octanate
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett vagy szedni tervezett egyéb gyógyszereiről beleértve a recept nélkül kapható készítményeket is.
A humán VIII-as véralvadási faktor termékek más gyógyszerkészítményekkel való interakciója nem ismert. Az Octanate azonban nem adható semmilyen más gyógyszerrel együtt egy infúzióban.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A gépjárművezetéséhez és a gépek kezeléséhez szükséges képességekre gyakorolt hatást nem figyeltek meg.
Az Octanate nátriumot tartalmaz
A készítmény kevesebb, mint 23 mg nátriumot tartalmaz Octanate 250 NE/injekciós, azaz gyakorlatilag "nátriummentes".
Ez a gyógyszer legfeljebb 40 mg nátriumot (a konyhasó fő összetevője) tartalmaz Octanate 500 és 1000 NE/injekciós , ami megfelel a nátrium ajánlott maximális napi bevitel 2%-ának felnőtteknél.
Ezt kontrollált nátrium diéta esetén figyelembe kell venni.
3. Hogyan kell alkalmazni az Octanate injekciót?
Az Octanate-et a mellékelt oldószerrel történő feloldás után intravénás injekció formájában kell beadni.
A kezelést orvos felügyelete alatt kell megkezdeni.
Adagolás a vérzés megelőzésére Amennyiben súlyos hemofília A-ban szenved, akkor a hosszú távú megelőzés érdekében két-három naponta testsúlykilogrammonként 20-40 NE faktort kell beadni. Az adag a válasz függvényében módosítható. Bizonyos esetekben nagyobb gyakoriságra vagy nagyobb adagra lehet szükség.
Adagolás számítása
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
A VIII-as faktor aktivitása a plazmában jelenlévő VIII-as faktor mennyiségére utal. A plazma VIII. faktor aktivitást százalékban (a normál emberi plazmához viszonyítva), vagy nemzetközi egységben (a plazma VIII. faktorra vonatkozó nemzetközi szabványhoz viszonyítva) fejezik ki. A VIII-as faktor adagját NE-ben fejezik ki.
Egy nemzetközi egységnyi (NE) VIII-as faktoraktivitás a normál emberi plazma 1 ml-ében lévő VIII-as faktor mennyiségének felel meg. 1 NE VIII-as faktor/ttkg a plazma VIII-as faktor aktivitását 1,5-2%-kal emeli. A szükséges dózis kiszámításához meghatározzák vérplazmájában a VIII. faktor aktivitást, valamint, hogy mennyivel kell ezt a szintet növelni. Amennyiben nem biztos az adag kiszámítási módjában vagy nem tudja, hogy mennyivel kell emelni a VIII-as faktor aktivitást, kérjük forduljon kezelőorvosához.
A szükséges adagot (NE) a következő képlettel lehet meghatározni:
Szükséges adag (NE) = testtömeg (kg) × a kívánt VIII-as faktoraktivitás-emelkedés (%) (NE/dl) × 0,5
A szükséges mennyiséget és a kezelés gyakoriságát mindig az egyedi esetben elért klinikai hatékonyságra való tekintettel kell meghatározni.
Az alábbi vérzéses epizódok esetén a megfelelő időtartam során a VIII-as faktoraktivitás szintje nem süllyedhet a megadott értékek alá (a normál érték százalékában).
A következő táblázat útmutatóként használható vérzéses epizódok és sebészeti beavatkozások során:

Kezelőorvosa fogja előírni Önnek az Octanate adagját és az adagolási gyakoriságot.
A VIII-as faktorra adott reakciója változó lehet, ezért a VIII-as faktor vérszintjét a kezelés során mérni kell, és ennek alapján kell meghatározni a pontos adagot és az infúzió gyakoriságát.
Egyes esetekben, elsősorban a kezdő adagra vonatkozóan, a számítottnál nagyobb mennyiségre lehet szükség.
A betegek eltérően reagálhatnak a VIII-as faktorra, eltérő in vivo hasznosulási szintet érhetnek el és különbség lehet a plazma-féléletidőben is.
A szubsztitúciós kezelés véralvadási vizsgálatokkal történő (a plazma VIII-as faktoraktivitásának) gondos nyomonkövetése - elsősorban a nagyobb sebészeti beavatkozások után - elengedhetetlen.
Vérzés megelőzése: A súlyos haemophilia-A-ban szenvedő betegeknél a vérzések hosszú távú megelőzésére 20-40 VIII-as faktor/ttkg adagot kell alkalmazni 2-3 napos intervallumokban. Egyes esetekben, főleg fiatal betegeknél, rövidebb intervallumokra vagy nagyobb adagokra lehet szükség.
Inhibitorok: A humán VIII-as koagulációs faktorral kezelt betegek esetében figyelemmel kell kísérni a gátló (inhibitor) antitestek termelődését. Ha a várt VIII. faktor szintet nem sikerül elérni, illetve ha a vérzés nem vonható kontroll alá a megfelelő adaggal, meg kell vizsgálni, nincs-e jelen a beteg szervezetében VIII. faktort gátló inhibitor. Ha az inhibitor szintje alacsonyabb, mint 10 Bethesda Egység (Bethesda Unit, BU)/ml, további VIII. humán koagulációs faktor adagolásával az inhibitor semlegesíthető. 10 BU feletti inhibitor titer esetén meg kell fontolni (aktivált) protrombin komplex koncentrátum (prothrombin complex concentrate, PCC) vagy rekombináns aktivált VII. faktor (rFVIIa) készítmények alkalmazását. Ezeket a kezeléseket hemofíliás betegek kezelésében jártas orvos irányítása alatt kell végezni.
Alkalmazása gyermekeknél
Klinikai vizságlatok során nem állapítottak meg speciálisan gyermekekre vonatkozó adagolási előírásokat. Az adagolás kezelés és megelőzés esetén is megegyezik a felnőtt adagolással.
Otthoni kezelésre vonatkozó utasítások
- Kérjük, gondosan olvassa el az utasításokat, és pontosan kövesse azokat!
- A címkén feltüntetett lejárati idő után ne alkalmazza a Octanate-t.
- A feloldott gyógyszerkészítményt vizuálisan vizsgálja meg, hogy tartalmaz-e szemcsés anyagot vagy elszíneződést.
- Az alább részletezett eljárás során a sterilitást mindvégig fenn kell tartani!
- Az oldatnak átlátszónak vagy opálosnak kell lennie. Ne használja az oldatot ha zavaros vagy csapadék látható benne.
- A mikrobák általi szennyeződés elkerülése érdekében azonnal használja fel az elkészített oldatot.
- Kizárólag a mellékelt infúziós készletet alkalmazza. Más injekciós/infúziós eszközök alkalmazása további kockázatokhoz és a kezelés sikertelenségéhez vezethet.
Utasítások az oldat elkészítéséhez:
1. Ne alkalmazza a készítményt közvetlenül azután, hogy kivette a hűtőszekrényből. Hagyja, hogy a zárt üvegekben lévő oldószer és por szobahőmérsékletűre melegedjenek.
2. Távolítsa el a port és az oldószert tartalmazó üvegek lepattintható kupakját, majd az egyik mellékelt alkoholos törlővel tisztítsa meg a gumidugókat.
3. Az áttöltőkészlet az 1. ábrán látható. Helyezze az oldószert tartalmazó üveget sík felületre, és tartsa stabilan. Fogja az áttöltőkészletet, és fordítsa tetejével lefelé. Az áttöltőkészlet kék részét helyezze az oldószeres üveg tetejére, majd határozottan nyomja le, amíg nem kattan (2. és 3. ábra). Ne forgassa a ráhelyezés közben.


Utasítások az injekció beadásához:
A biztonság kedvéért a pulzusát a befecskendezés előtt és annak folyamán mérni kell. Ha a pulzus észrevehetően emelkedik, akkor a befecskendezés sebességét le kell lassítani, vagy a beadást rövid ideig meg kell szakítani.
1. Csatlakoztassa a fecskendőt az áttöltőkészlet fehér részéhez. Fordítsa az injekciós üveget tetejével lefelé, és szívjon oldatot a fecskendőbe (6. ábra).
A fecskendőben lévő oldatnak átlátszónak vagy enyhén opálosnak kell lennie. Ha az oldat átkerült a fecskendőbe, akkor tartsa stabilan a fecskendő dugattyúját (úgy, hogy az lefelé nézzen), majd távolítsa el a fecskendőt az áttöltőkészletről (7. ábra).
Dobja ki az üres üveget az áttöltőkészlet fehér részével együtt.

2. Az egyik mellékelt alkoholos törlő segítségével tisztítsa meg a megszúrandó bőrfelületet.
3. Csatlakoztassa a mellékelt infúziósszereléket a fecskendőhöz.
4. Szúrja az injekciós tűt a kiválasztott vénába. Amennyiben leszorítást alkalmazott a véna jobb észlelhetősége céljából, akkor ezt a leszorítást a Octanate beadása előtt fel kell engedni.
5. A fibrinalvadékok képződésének veszélye miatt nem szabad hagyni, hogy a vér visszafolyjon a fecskendőbe.
6. Lassan fecskendezze be a vénába, nem gyorsabban mint 2-3 ml/perc.
Ha Ön egynél több injekciós üvegnyi Octanate port alkalmaz, akkor használhatja ugyanezt az injekciós tűt és fecskendőt. Az áttöltőkészlet csak egyszer használatos.
Bármilyen fel nem használt termék, illetve hulladékanyag megsemmisítését a gyógyszerekre vonatkozó előírások szerint kell végrehajtani.
Ha az előírtnál több Octanate injekciót kapott:
Nem jegyeztek a humán VIII-as koagulációs faktor túladagolásával kapcsolatos tüneteket. A javasolt adagot azonban nem szabad túllépni.
Ha elfelejtették alkalmazni az Octanate injekciót:
Ne adjon be kétszeres adagot a kihagyott adag pótlására. Azonnal adja be a következő adagot és folytassa a kezelést a kezelőorvos vagy a gyógyszerész útmutatásai szerint.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ritkán (1000-ből legfeljebb 1 embert érinthet) megfigyeltek túlérzékenységet vagy allergiás reakciókat a VIII-as faktor tartalmú készítményekkel kezelt betegek körében.
Az alábbi tünetek jelentkezése esetén forduljon kezelőorvosához:
hányás, az infúziós területen égető vagy szúró érzés, mellkasi nyomásérzés, hidegrázás, felgyorsult szívverés (tachikardia), hányinger, bizsergés, kivörösödés, fejfájás, csalánikütés, alacsony vérnyomás, kiütés, nyugtalanság, az arc, az ajak, a száj, a nyelv vagy a torok nyelési vagy légzési nehézséget okozó duzzanata (angioödéma), fáradtság (letargia), zihálás.
Nagyon ritkán (10 000-ből legfeljebb 1 embert érinthet) a túlérzékenység súlyos, életveszélyes allergiás reakciót, úgynevezett anafilaxist okozhat, amelynek során sokk, illetve a fenti tünetek bármelyike vagy akár az összes jelentkezhet. Ebben az esetben azonnal keresse fel orvosát vagy hívjon mentőt.
Egyéb ritka mellékhatások (1000-ből legfeljebb 1 embert érinthet)
Ritka esetekben lázat is megfigyeltek.
A VIII-as faktor készítménnyel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1 esetben) inhibitor ellenanyagok (gátló hatású antitestek) jelenhetnek meg (lásd 2. pont); a VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél a kockázat nem gyakori(100 beteg közül kevesebb mint 1 esetben). Ha bekövetkezik ez a szövődmény, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
A vírusbiztonságosságra vonatkozó információt lásd a 2. pontban. (Figyelmeztetések és óvintézkedések - Az Octanate előállításához használt vérre és plazmára vonatkozó információk).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell az Octanate injekciót tárolni?
2 °C és 25 °C között, fénytől védve tárolandó.
Nem fagyasztható.
A gyógyszer gyermekektől elzárva tartandó!
A címkén feltüntetett lejárati idő után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Az elkészített oldatot azonnal fel kell használni és csak egyszeri használatra szolgál.
Ne alkalmazza a gyógyszert, ha zavaros vagy a por nem oldódott fel teljes mértékben.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz az Octanate?
A készítmény hatóanyaga: Humán koagulációs VIII. faktor, fagyasztással szárítva.
Porampulla:
Octanate 25: 250 Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max. 5mg
Octanate 500: 500 Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max 11 mg
Octanate 1000: 1000 Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max 22 mg
Egyéb összetevők: nátrium-citrát, nátrium klorid, kalcium-klorid, glicin.
Oldószert tartalmazó injekciós üveg:
Injekcióhoz való víz
Az Octanate nem tartalmaz antimikrobiális vagy tartósító szereket.
Leírás: Injekció: fehér vagy halványsárga színű, liofilezett, steril por + oldószer (színtelen, tiszta steril injekcióhoz való víz)
Milyen az Octanate külleme és mit tartalmaz a csomagolás?
Csomagolás:
Porampulla: liofilezett por, halobutil gumidugóval, rollnizott alumíniumkupakkal és lepattintható műanyag fedéllel lezárt színtelen injekciós üvegbe (I. típusú) töltve.
Oldószert tartalmazó injekciós üveg:
5 (Octanate 250), 10 (Octanate 500, Octanate 1000) színtelen, tiszta steril injekcióhoz való víz, halobutil gumidugóval, rollnizott alumíniumkupakkal és lepattintható műanyag fedéllel lezárt színtelen injekciós üvegbe töltve.
- 1db, az intravénás injekció alkalmazásához szükséges készlet (1 db áttöltőkészlet, 1 db infúziós szerelék és 1 db egyszer használatos fecskendő)
- 2 darab alkoholos törlő
Az Octanate műanyag fóliával összekapcsolt két dobozból álló kombinált csomagolásban kerül forgalomba.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
Fogyasztói ár:
142340Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 142340 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026



















