
HUMACLOT 500 NE por és oldószer oldatos injekcióhoz
ATC
VIII koagulációs faktor
Hatóanyag
factor viii
HUMACLOT 500 NE por és oldószer oldatos injekcióhoz betegtájékoztatója
1. Milyen típusú gyógyszer a Humaclot és milyen betegségek esetén alkalmazható?
A Humaclot emberi plazmából előállított VIII-as véralvadási faktort tartalmazó készítmény. A VIII-as véralvadási faktor egy fehérje, amely részt vesz a véralvadás folyamatában.
A Humaclot alkalmazható:
- vérzés kezelésére és megelőzésére örökletes (veleszületett) VIII-as véralvadási faktorhiány esetén (Hemofília A);
- vérzés kezelésére szerzett VIII-as véralvadási faktorhiány esetén;
- VIII-as véralvadási faktor elleni antitestekkel (inhibitorok) rendelkező hemofíliás betegek kezelésére.
2. Tudnivalók a Humaclot alkalmazása előtt
Ne alkalmazza a Humaclot injekciót:
- ha Ön allergiás (túlérzékeny) a humán VIII. véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
Figyelmeztetések és óvintézkedések
A Humaclot alkalmazása előtt beszéljen kezelőorvosával vagy a gondozását végző egészségügyi szakemberrel.
Allergiás reakció
A Humaclot használata során előfordulhatnak allergiás jellegű túlérzékenységi (hiperszenzitivitási) reakciók.
A készítmény nyomokban a humán VIII-as véralvadási faktortól eltérő humán fehérjét is tartalmaz.
Amennyiben a készítmény alkalmazása során az alább felsorolt tüneteket tapasztalja, az injekció beadását azonnal le kell állítani, és orvoshoz kell fordulni, mivel ezek a túlérzékenység jelei lehetnek: bőrkiütés, általános csalánkiütés, zihálás, vérnyomásesés, akár súlyos allergiás reakció.
Keringés-összeomlás (sokk) fellépésekor a sokk kezelésére vonatkozó jelenlegi terápiás irányelvek szerint kell eljárni.
Inhibitorok
Az inhibitorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák, hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem kontrollálható Önnél, illetve gyermekénél a Humaclottal, azonnal tájékoztassa erről kezelőorvosát.
Szívbetegségek
Amennyiben Ön szívbetegségben szenved vagy szívbetegség kockázata áll fenn Önnél, beszéljen kezelőorvosával vagy gyógyszerészével a készítmény alkalmazása előtt.
Kanüllel kapcsolatos szövődmények
Amennyiben centrális vénás kanül szükséges a készítmény adásához, fennállhatnak Önnél a centrális vénás kanüllel kapcsolatos szövődmények, köztük a helyi fertőzések, baktériumok véráramba kerülésének (bakterémia), valamint a kanül bevezetésének helyén az érben kialakuló vérrög (trombózis) kockázata.
Vírusbiztonság
Emberi vérből vagy plazmából készült gyógyszerkészítmények előállítása során bizonyos intézkedéseket vezettek be azért, hogy elkerüljék a fertőzések átvitelét a betegekbe. Ezen intézkedésekhez tartoznak:
- a vér- és plazmaadók gondos kiválasztása azért, hogy a fertőzést hordozó személyeket kizárják,
- a vérvétel mintájának egyedi vizsgálata és a plazmakeverékek vizsgálata vírus/fertőzés jeleire,
- olyan lépések beillesztése a gyártási folyamatba, amelyek képesek eltávolítani vagy inaktiválni a vírusokat.
Mindezen eljárások ellenére, emberi vérből vagy plazmából előállított gyógyszerek alkalmazásakor a fertőző betegségek átvitelének lehetősége nem zárható ki teljesen. Ez jelentheti akár eddig ismeretlen vagy új vírusok és más kórokozók átvitelét is.
Az alkalmazott eljárások hatékonynak tekinthetők az olyan vírusok ellen, mint az emberi immundeficiencia vírus (HIV), a hepatitisz B vírus (HBV), a hepatitisz C vírus (HCV), valamint a burokkal nem rendelkező hepatitisz A vírus (HAV). A lipidburokkal nem rendelkező parvovírus B19 esetében ezen eljárások hatékonysága korlátozott lehet. A parvovírus B19-fertőzés terhességben, illetve immunhiányos betegségekben és megnövekedett vörösvértest-termeléssel járó kórképekben járhat súlyos következményekkel, így a készítmény alkalmazása ezen esetekben nem javasolt.
Minden egyes alkalommal, amikor Humaclot-kezelésben részesül, szigorúan ajánlott a készítmény nevének és gyártási számának dokumentálása, hogy a kezelésben részesülő személy és a gyártási tétel közötti kapcsolat rögzítésre kerüljön.
Amennyiben rendszeres emberi plazmából származó VIII-as véralvadásifaktor-kezelésre szorul, kezelőorvosa elrendelheti a megfelelő védőoltások (hepatitisz A, illetve hepatitisz B) alkalmazását.
Gyermekek és serdülők
Nem állnak rendelkezésre gyermekekre és serdülőkre vonatkozó specifikus adatok. További információ a betegtájékoztató végén, az orvosoknak vagy egészségügyi szakembereknek szóló részben található.
Egyéb gyógyszerek és a Humaclot
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett, valamint alkalmazni tervezett egyéb gyógyszereiről.
Nem jelentettek humán VIII-as véralvadási faktor és egyéb gyógyszerek közötti gyógyszerkölcsönhatást.
Nem állnak rendelkezésre gyermekekre és serdülőkre vonatkozó specifikus adatok.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával.
Tekintettel a hemofília A nőknél való ritka előfordulására, nem áll rendelkezésre tapasztalat a VIII-as faktor terhesség alatt és szoptatás során történő alkalmazásáról. Ezért a VIII-as faktor csak egyértelmű javallat esetén alkalmazható a terhesség alatt és a szoptatás során.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Nem ismert, hogy a készítmény a fenti képességeket befolyásolná.
A Humaclot nátriumot tartalmaz
A feloldott Humaclot 500 NE és 1000 NE készítmények legfeljebb 41 mg nátriumot (a konyhasó fő összetevője) tartalmaznak üvegenként (10 ml), ami megfelel a nátrium ajánlott maximális napi bevitel 2,05%-ának felnőtteknél.
3. Hogyan kell alkalmazni a Humaclotot?
A Humaclot beadását orvos vagy képzett ápolószemélyzet végzi. A gyógyszert injekció vagy infúzió formájában vénába (intravénásan) adják.
Ha Önnek otthoni alkalmazásra írták elő a Humaclot injekciót, orvosa megbizonyosodik arról, hogy Ön ismeri az alkalmazás módját és a helyes adagolást. Gondosan kövesse kezelőorvosa vagy a hemofília gondozó szakdolgozójának útmutatásait. Amennyiben bizonytalan az alkalmazás módját illetően, kérjen segítséget orvosától vagy a hemofília központ szakdolgozójától.
Adagolás
A szükséges VIII-as faktor mennyiségét és az alkalmazás időtartamát a faktorhiány súlyossága, a vérzés helye és mértéke, valamint az Ön klinikai állapota alapján határozzák meg.
Vérzés kezelése
A szükséges mennyiséget és a kezelés gyakoriságát az Ön esetében elért klinikai hatékonyságra való tekintettel kell meghatározni.
Vérzés megelőzése
A súlyos hemofília A-ban szenvedő betegeknél a vérzések hosszú távú megelőzésére 20-40 NE VIII-as faktor/ttkg adagot kell alkalmazni 2-3 napos intervallumokban. Egyes esetekben, főleg fiatal betegeknél, rövidebb intervallumokra vagy nagyobb adagokra lehet szükség.
A humán VIII-as véralvadási faktorral kezelt betegek esetében figyelemmel kell kísérni a gátló antitestek (inhibitorok) termelődését.
A kezelés alatt a VIII-as faktorszint pontos meghatározása szükséges, hogy segítse a megfelelő mennyiségnek és az infúzió adás gyakoriságának megállapítását. Különösen nagy műtéti beavatkozások esetén szükséges a faktorpótló terápia véralvadási vizsgálattal (plazma VIII-as faktor aktivitás) történő pontos monitorozása.
Alkalmazás gyermekeknél és serdülőknél
A Humaclot biztonságosságát és hatásosságát 12 év alatti gyermekek esetében még nem igazolták. Serdülők esetében (12-18 év) az egyes indikációkban a gyógyszer adagolása a testtömeg alapján történik.
További információk az adagolásról és a kezelési időről a betegtájékoztató végén a kizárólag egészségügyi szakembereknek szóló részben találhatók.
A készítmény kezelésével kapcsolatos információk
A készítményt intravénásan, injekció vagy lassú infúzió formájában kell beadni.
Intravénás injekció esetén az injekció beadásának időtartama általában 3-5 perc a pulzusszám ellenőrzése mellett, ha a pulzusszám emelkedik, szakítsa meg a beadást vagy csökkentse az injekció beadási sebességét.
Az infúzió beadási sebességét egyénileg kell megállapítani.
Csak a készítményhez csomagolt injekciós/infúziós készletet használja, bizonyos eszközök belső felületükön megkötik a humán VIII-as véralvadási faktort, mely a kezelés eredménytelenségét okozhatja.
Inkompatibilitás: kompatibilitási vizsgálatok hiányában, a Humaclot nem keverhető más gyógyszerkészítményekkel.
A por feloldása az oldószerben
1. Melegítse a port és az oldószert szobahőmérsékletre.
2. Ezt a hőmérsékletet kell tartani a teljes feloldódás ideje alatt (max. 10 perc).
3. Távolítsa el a port és az oldószert tartalmazó injekciós üveg kupakját.
4. Tisztítsa meg alkohollal a két injekciós üveg dugójának felületét.
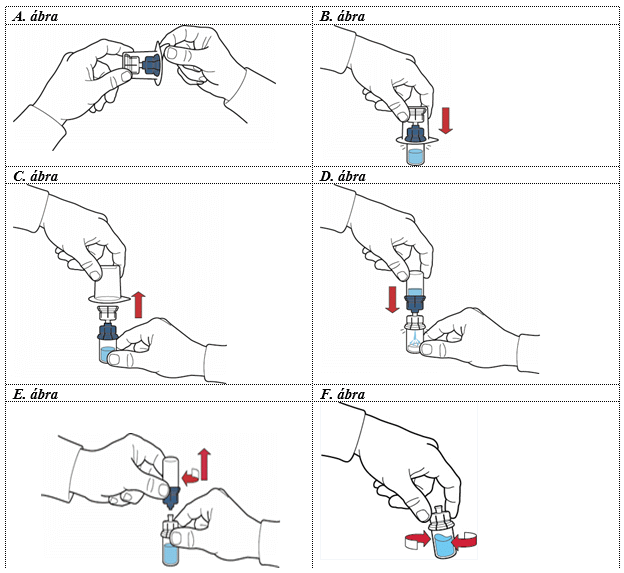
5. A fedőlap lehúzásával nyissa meg a segédeszköz csomagolását; ügyeljen arra, hogy ne érjen hozzá a benne lévő részekhez (A. ábra).
6. Ne vegye ki a segédeszközt a csomagolásból.
7. Fordítsa fejjel lefelé a segédeszközt tartalmazó dobozt és nyomja át a műanyag tűt az oldószeres injekciós üveg dugóján úgy, hogy a segédeszköz kék része csatlakozzon az oldószeres injekciós üveghez (B. ábra).
8. Fogja meg a segédeszköz doboz peremét és távolítsa el anélkül, hogy hozzáérne az eszközhöz (C. ábra).
9. Győződjön meg, hogy a port tartalmazó injekciós üveget sima, tiszta felületre helyezte, majd fordítsa fejjel lefelé az eszközrendszert, hogy az oldószeres injekciós üveg az eszköz tetején legyen. Nyomja rá a segédeszköz átlátszó részét a port tartalmazó üveg dugójára úgy, hogy a műanyag tű átmenjen a port tartalmazó üveg gumidugóján, így az oldószer automatikusan átfolyik a port tartalmazó üvegbe (D. ábra).
10. Miután az oldat átfolyt, a segédeszköz kék csatlakozó részét, amelyhez az oldatot tartalmazó injekciós üveg csatlakozik, tekerje le és távolítsa el (E. ábra).
11. Óvatosan mozgassa az injekciós üveget, amíg a készítmény teljesen feloldódik (F. ábra).
12. A habzás elkerülése érdekében ne rázza az üveget erőteljesen.
Az oldat adagolása
A készítményben a feloldást követően előfordulhat néhány pehely vagy részecske.
Beadás előtt az oldatot vizuálisan meg kell vizsgálni szilárd részecskék vagy elszíneződés jelenlétére. Az oldószer tiszta vagy enyhén opálos. Ne használjon olyan oldatot, amely zavaros vagy csapadékos.
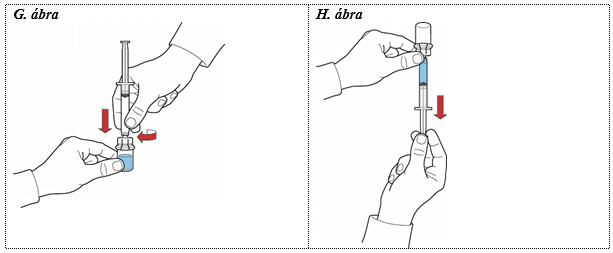
1. Töltse meg a fecskendőt levegővel, visszafelé húzva a dugattyút, majd csatlakoztassa a segédeszközhöz az óramutató járásával megegyező irányba csavarva és fecskendezze a levegőt a feloldott port tartalmazó injekciós üvegbe (G. ábra).
2. Tartsa a dugattyút mozdulatlan helyzetben és fordítsa fejjel lefelé az eszközrendszert úgy, hogy a feloldott port tartalmazó injekciós üveg az eszköz tetején legyen, majd a dugattyú lassú visszafelé húzásával szívja fel a koncentrátumot a fecskendőbe (H. ábra).
3. A Mix2Vial készlet átlátszó részét válassza le a fecskendőről az óramutató járásával ellentétes irányba csavarva.
4. Vizsgálja meg vizuálisan a fecskendőben lévő oldatot. Tisztának vagy enyhén opálosnak kell lennie, nem tartalmazhat szilárd részecskéket.
5. Csatlakoztassa az infúziós kanült a fecskendőhöz, majd infundálja vagy lassan injektálja intravénásan az oldatot.
Ha az előírtnál több Humaclotot alkalmazott
Túladagolás következményei nem ismertek.
Ha az előírtnál több Humaclotot alkalmazott, értesítse kezelőorvosát vagy a legközelebbi kórházat.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ha a felsorolt tünetek közül bármelyiket észleli, kérjük tájékoztassa a kezelőorvosát vagy a legközelebbi kórházat.
- Súlyos allergiás reakció (hiperszenzitivitás): a bőr és a nyálkahártya gyors duzzanata a száj és az arc körül (angioödéma). Ezen mellékhatások ritkán alakulnak ki, ritkán súlyos allergiás reakcióhoz vezethetnek, beleértve az anafilaxiás sokkot is.
- Hemofília A-ban szenvedő betegeknél a VIII-as faktort semlegesítő antitestek (inhibitorok) jelenhetnek meg. Ezen inhibitorok jelenléte elégtelen klinikai válaszként jelentkezik. Ilyen esetekben ajánlott egy speciális hemofíliás központtal kapcsolatba lépni.
További mellékhatások
- Egyéb allergiás reakciók (hiperszenzivitás), beleértve:
-- égető és szúró érzés az infúzió beadásának helyén,
-- hidegrázás, kipirulás, a test egészén jelentkező csalánkiütés, kiütések,
-- fejfájás,
-- vérnyomásesés, nyugtalanság, szapora szívdobogás (tahikardia), mellkasi szorító érzés, zihálás,
-- levertség (letargia),
-- hányinger, hányás,
-- zsibbadás.
Ezeket a mellékhatásokat ritkán figyelték meg, azonban egyes esetekben súlyos allergiás reakció (anafilaxia) alakulhat ki, beleértve a sokkot is.
- Lázat is megfigyeltek.
A VIII-as faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
További mellékhatások gyermekeknél
Bár a gyermekpopulációra vonatkozóan nincsenek specifikus adatok, a hatásossági és biztonságossági vizsgálatokkal kapcsolatos néhány közzétett adat nem mutatott jelentős különbséget a felnőttek és az azonos betegségben szenvedő gyermekek között.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik.
A mellékhatásokat közvetlenül a hatóság részére is bejelentheti postai úton az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet Postafiók 450, H-1372 Budapest címre, vagy elektronikusan a www.ogyei.gov.hu honlapon keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
A vírusbiztonsággal kapcsolatos információkat lásd a "2. Tudnivalók a Humaclot alkalmazása előtt" pontban.
5. Hogyan kell a Humaclotot tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és a címkén feltüntetett lejárati idő (Felhasználható:/Felh.:) után ne alkalmazza a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C - 8 °C) tárolandó. Nem fagyasztható!
A fénytől való védelem érdekében az injekciós üveg a külső csomagolásban tárolandó.
Felhasználás előtt ellenőrizze a gyógyszer, a mellékelt fecskendő és a szerelékek csomagolásának sértetlenségét. Csak a sértetlen csomagolású gyógyszert és eszközöket használja fel.
Szobahőmérsékleten (max. +25 °C) a készítmény 6 hónapig tárolható. Ennek megfelelően a felhasználhatóság az eltarthatósági időtartamon belül lejár 6 hónappal azután, hogy a készítményt a hűtőszekrényből először kivették. Ezután az időszak után a készítményt meg kell semmisíteni. Szobahőmérsékleten való tárolás után, a készítmény nem tehető vissza a hűtőszekrénybe.
Az új felhasználhatósági határidőt a külső dobozon fel kell tüntetni. Az elkészített injekciós oldatot csak egyetlen alkalommal szabad felhasználni.
Felbontás után a készítményt azonnal fel kell használni. Az injekciós üveg tartalmát egyszerre kell beadni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Humaclot?
- A készítmény hatóanyaga: liofilizált humán plazma eredetű VIII-as véralvadási faktor.
A Humaclot por és oldószer oldatos injekcióhoz gyógyszerformában az alábbi összetevőket tartalmazza:

Az aktivitást (NE) az Európai Gyógyszerkönyv kromogén vizsgálati módszerével határozzák meg.
A Humaclot fajlagos aktivitása kb. 80 NE/mg fehérje.
Előállítása humán donorok plazmájából történik.
A készítmény Von Willebrand faktort is tartalmaz.
- Egyéb összetevők:
Port tartalmazó injekciós üveg: trinátrium-citrát, nátrium-klorid, glicin, kalcium-klorid
Oldószert tartalmazó injekciós üveg: injekcióhoz való víz.
Milyen a Humaclot külleme és mit tartalmaz a csomagolás?
Por és oldószer oldatos injekcióhoz
A készítményben a feloldást követően előfordulhat néhány pehely vagy részecske. Beadás előtt az oldatot vizuálisan ellenőrizni kell a szilárd részecskék vagy elszíneződés jelenlétét keresve.
A Humaclot oldat tiszta vagy enyhén opálos. Ne használjon olyan oldatot, amely zavaros vagy csapadékos.
Humaclot 500 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: fehér vagy halványsárga színű, higroszkópos por vagy porlékony szilárd anyag.
Oldószert tartalmazó injekciós üveg: színtelen, tiszta, steril folyadék.
Csomagolás
- 1 db port tartalmazó injekciós üveg
- 1 db oldószert tartalmazó injekciós üveg
- 1 db steril áttöltő eszköz szűrővel (Mix2Vial)
- 1 db egyszer használatos fecskendő
- 1 db infúziós kanül
- 2 db alkoholos törlőkendő
- 1 db sebtapasz
Humaclot 1000 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: fehér vagy halványsárga színű, higroszkópos por vagy porlékony szilárd anyag.
Oldószert tartalmazó injekciós üveg: színtelen, tiszta, steril folyadék.
Csomagolás
- 1 db port tartalmazó injekciós üveg
- 1 db oldószert tartalmazó injekciós üveg
- 1 db steril áttöltő eszköz szűrővel (Mix2Vial)
- 1 db egyszer használatos fecskendő
- 1 db infúziós kanül
- 2 db alkoholos törlőkendő
- 1 db sebtapasz
A Humaclot emberi plazmából előállított VIII-as véralvadási faktort tartalmazó készítmény. A VIII-as véralvadási faktor egy fehérje, amely részt vesz a véralvadás folyamatában.
A Humaclot alkalmazható:
- vérzés kezelésére és megelőzésére örökletes (veleszületett) VIII-as véralvadási faktorhiány esetén (Hemofília A);
- vérzés kezelésére szerzett VIII-as véralvadási faktorhiány esetén;
- VIII-as véralvadási faktor elleni antitestekkel (inhibitorok) rendelkező hemofíliás betegek kezelésére.
2. Tudnivalók a Humaclot alkalmazása előtt
Ne alkalmazza a Humaclot injekciót:
- ha Ön allergiás (túlérzékeny) a humán VIII. véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
Figyelmeztetések és óvintézkedések
A Humaclot alkalmazása előtt beszéljen kezelőorvosával vagy a gondozását végző egészségügyi szakemberrel.
Allergiás reakció
A Humaclot használata során előfordulhatnak allergiás jellegű túlérzékenységi (hiperszenzitivitási) reakciók.
A készítmény nyomokban a humán VIII-as véralvadási faktortól eltérő humán fehérjét is tartalmaz.
Amennyiben a készítmény alkalmazása során az alább felsorolt tüneteket tapasztalja, az injekció beadását azonnal le kell állítani, és orvoshoz kell fordulni, mivel ezek a túlérzékenység jelei lehetnek: bőrkiütés, általános csalánkiütés, zihálás, vérnyomásesés, akár súlyos allergiás reakció.
Keringés-összeomlás (sokk) fellépésekor a sokk kezelésére vonatkozó jelenlegi terápiás irányelvek szerint kell eljárni.
Inhibitorok
Az inhibitorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák, hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem kontrollálható Önnél, illetve gyermekénél a Humaclottal, azonnal tájékoztassa erről kezelőorvosát.
Szívbetegségek
Amennyiben Ön szívbetegségben szenved vagy szívbetegség kockázata áll fenn Önnél, beszéljen kezelőorvosával vagy gyógyszerészével a készítmény alkalmazása előtt.
Kanüllel kapcsolatos szövődmények
Amennyiben centrális vénás kanül szükséges a készítmény adásához, fennállhatnak Önnél a centrális vénás kanüllel kapcsolatos szövődmények, köztük a helyi fertőzések, baktériumok véráramba kerülésének (bakterémia), valamint a kanül bevezetésének helyén az érben kialakuló vérrög (trombózis) kockázata.
Vírusbiztonság
Emberi vérből vagy plazmából készült gyógyszerkészítmények előállítása során bizonyos intézkedéseket vezettek be azért, hogy elkerüljék a fertőzések átvitelét a betegekbe. Ezen intézkedésekhez tartoznak:
- a vér- és plazmaadók gondos kiválasztása azért, hogy a fertőzést hordozó személyeket kizárják,
- a vérvétel mintájának egyedi vizsgálata és a plazmakeverékek vizsgálata vírus/fertőzés jeleire,
- olyan lépések beillesztése a gyártási folyamatba, amelyek képesek eltávolítani vagy inaktiválni a vírusokat.
Mindezen eljárások ellenére, emberi vérből vagy plazmából előállított gyógyszerek alkalmazásakor a fertőző betegségek átvitelének lehetősége nem zárható ki teljesen. Ez jelentheti akár eddig ismeretlen vagy új vírusok és más kórokozók átvitelét is.
Az alkalmazott eljárások hatékonynak tekinthetők az olyan vírusok ellen, mint az emberi immundeficiencia vírus (HIV), a hepatitisz B vírus (HBV), a hepatitisz C vírus (HCV), valamint a burokkal nem rendelkező hepatitisz A vírus (HAV). A lipidburokkal nem rendelkező parvovírus B19 esetében ezen eljárások hatékonysága korlátozott lehet. A parvovírus B19-fertőzés terhességben, illetve immunhiányos betegségekben és megnövekedett vörösvértest-termeléssel járó kórképekben járhat súlyos következményekkel, így a készítmény alkalmazása ezen esetekben nem javasolt.
Minden egyes alkalommal, amikor Humaclot-kezelésben részesül, szigorúan ajánlott a készítmény nevének és gyártási számának dokumentálása, hogy a kezelésben részesülő személy és a gyártási tétel közötti kapcsolat rögzítésre kerüljön.
Amennyiben rendszeres emberi plazmából származó VIII-as véralvadásifaktor-kezelésre szorul, kezelőorvosa elrendelheti a megfelelő védőoltások (hepatitisz A, illetve hepatitisz B) alkalmazását.
Gyermekek és serdülők
Nem állnak rendelkezésre gyermekekre és serdülőkre vonatkozó specifikus adatok. További információ a betegtájékoztató végén, az orvosoknak vagy egészségügyi szakembereknek szóló részben található.
Egyéb gyógyszerek és a Humaclot
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett, valamint alkalmazni tervezett egyéb gyógyszereiről.
Nem jelentettek humán VIII-as véralvadási faktor és egyéb gyógyszerek közötti gyógyszerkölcsönhatást.
Nem állnak rendelkezésre gyermekekre és serdülőkre vonatkozó specifikus adatok.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával.
Tekintettel a hemofília A nőknél való ritka előfordulására, nem áll rendelkezésre tapasztalat a VIII-as faktor terhesség alatt és szoptatás során történő alkalmazásáról. Ezért a VIII-as faktor csak egyértelmű javallat esetén alkalmazható a terhesség alatt és a szoptatás során.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Nem ismert, hogy a készítmény a fenti képességeket befolyásolná.
A Humaclot nátriumot tartalmaz
A feloldott Humaclot 500 NE és 1000 NE készítmények legfeljebb 41 mg nátriumot (a konyhasó fő összetevője) tartalmaznak üvegenként (10 ml), ami megfelel a nátrium ajánlott maximális napi bevitel 2,05%-ának felnőtteknél.
3. Hogyan kell alkalmazni a Humaclotot?
A Humaclot beadását orvos vagy képzett ápolószemélyzet végzi. A gyógyszert injekció vagy infúzió formájában vénába (intravénásan) adják.
Ha Önnek otthoni alkalmazásra írták elő a Humaclot injekciót, orvosa megbizonyosodik arról, hogy Ön ismeri az alkalmazás módját és a helyes adagolást. Gondosan kövesse kezelőorvosa vagy a hemofília gondozó szakdolgozójának útmutatásait. Amennyiben bizonytalan az alkalmazás módját illetően, kérjen segítséget orvosától vagy a hemofília központ szakdolgozójától.
Adagolás
A szükséges VIII-as faktor mennyiségét és az alkalmazás időtartamát a faktorhiány súlyossága, a vérzés helye és mértéke, valamint az Ön klinikai állapota alapján határozzák meg.
Vérzés kezelése
A szükséges mennyiséget és a kezelés gyakoriságát az Ön esetében elért klinikai hatékonyságra való tekintettel kell meghatározni.
Vérzés megelőzése
A súlyos hemofília A-ban szenvedő betegeknél a vérzések hosszú távú megelőzésére 20-40 NE VIII-as faktor/ttkg adagot kell alkalmazni 2-3 napos intervallumokban. Egyes esetekben, főleg fiatal betegeknél, rövidebb intervallumokra vagy nagyobb adagokra lehet szükség.
A humán VIII-as véralvadási faktorral kezelt betegek esetében figyelemmel kell kísérni a gátló antitestek (inhibitorok) termelődését.
A kezelés alatt a VIII-as faktorszint pontos meghatározása szükséges, hogy segítse a megfelelő mennyiségnek és az infúzió adás gyakoriságának megállapítását. Különösen nagy műtéti beavatkozások esetén szükséges a faktorpótló terápia véralvadási vizsgálattal (plazma VIII-as faktor aktivitás) történő pontos monitorozása.
Alkalmazás gyermekeknél és serdülőknél
A Humaclot biztonságosságát és hatásosságát 12 év alatti gyermekek esetében még nem igazolták. Serdülők esetében (12-18 év) az egyes indikációkban a gyógyszer adagolása a testtömeg alapján történik.
További információk az adagolásról és a kezelési időről a betegtájékoztató végén a kizárólag egészségügyi szakembereknek szóló részben találhatók.
A készítmény kezelésével kapcsolatos információk
A készítményt intravénásan, injekció vagy lassú infúzió formájában kell beadni.
Intravénás injekció esetén az injekció beadásának időtartama általában 3-5 perc a pulzusszám ellenőrzése mellett, ha a pulzusszám emelkedik, szakítsa meg a beadást vagy csökkentse az injekció beadási sebességét.
Az infúzió beadási sebességét egyénileg kell megállapítani.
Csak a készítményhez csomagolt injekciós/infúziós készletet használja, bizonyos eszközök belső felületükön megkötik a humán VIII-as véralvadási faktort, mely a kezelés eredménytelenségét okozhatja.
Inkompatibilitás: kompatibilitási vizsgálatok hiányában, a Humaclot nem keverhető más gyógyszerkészítményekkel.
A por feloldása az oldószerben
1. Melegítse a port és az oldószert szobahőmérsékletre.
2. Ezt a hőmérsékletet kell tartani a teljes feloldódás ideje alatt (max. 10 perc).
3. Távolítsa el a port és az oldószert tartalmazó injekciós üveg kupakját.
4. Tisztítsa meg alkohollal a két injekciós üveg dugójának felületét.
5. A fedőlap lehúzásával nyissa meg a segédeszköz csomagolását; ügyeljen arra, hogy ne érjen hozzá a benne lévő részekhez (A. ábra).
6. Ne vegye ki a segédeszközt a csomagolásból.
7. Fordítsa fejjel lefelé a segédeszközt tartalmazó dobozt és nyomja át a műanyag tűt az oldószeres injekciós üveg dugóján úgy, hogy a segédeszköz kék része csatlakozzon az oldószeres injekciós üveghez (B. ábra).
8. Fogja meg a segédeszköz doboz peremét és távolítsa el anélkül, hogy hozzáérne az eszközhöz (C. ábra).
9. Győződjön meg, hogy a port tartalmazó injekciós üveget sima, tiszta felületre helyezte, majd fordítsa fejjel lefelé az eszközrendszert, hogy az oldószeres injekciós üveg az eszköz tetején legyen. Nyomja rá a segédeszköz átlátszó részét a port tartalmazó üveg dugójára úgy, hogy a műanyag tű átmenjen a port tartalmazó üveg gumidugóján, így az oldószer automatikusan átfolyik a port tartalmazó üvegbe (D. ábra).
10. Miután az oldat átfolyt, a segédeszköz kék csatlakozó részét, amelyhez az oldatot tartalmazó injekciós üveg csatlakozik, tekerje le és távolítsa el (E. ábra).
11. Óvatosan mozgassa az injekciós üveget, amíg a készítmény teljesen feloldódik (F. ábra).
12. A habzás elkerülése érdekében ne rázza az üveget erőteljesen.

Az oldat adagolása
A készítményben a feloldást követően előfordulhat néhány pehely vagy részecske.
Beadás előtt az oldatot vizuálisan meg kell vizsgálni szilárd részecskék vagy elszíneződés jelenlétére. Az oldószer tiszta vagy enyhén opálos. Ne használjon olyan oldatot, amely zavaros vagy csapadékos.
1. Töltse meg a fecskendőt levegővel, visszafelé húzva a dugattyút, majd csatlakoztassa a segédeszközhöz az óramutató járásával megegyező irányba csavarva és fecskendezze a levegőt a feloldott port tartalmazó injekciós üvegbe (G. ábra).
2. Tartsa a dugattyút mozdulatlan helyzetben és fordítsa fejjel lefelé az eszközrendszert úgy, hogy a feloldott port tartalmazó injekciós üveg az eszköz tetején legyen, majd a dugattyú lassú visszafelé húzásával szívja fel a koncentrátumot a fecskendőbe (H. ábra).
3. A Mix2Vial készlet átlátszó részét válassza le a fecskendőről az óramutató járásával ellentétes irányba csavarva.
4. Vizsgálja meg vizuálisan a fecskendőben lévő oldatot. Tisztának vagy enyhén opálosnak kell lennie, nem tartalmazhat szilárd részecskéket.
5. Csatlakoztassa az infúziós kanült a fecskendőhöz, majd infundálja vagy lassan injektálja intravénásan az oldatot.

Ha az előírtnál több Humaclotot alkalmazott
Túladagolás következményei nem ismertek.
Ha az előírtnál több Humaclotot alkalmazott, értesítse kezelőorvosát vagy a legközelebbi kórházat.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ha a felsorolt tünetek közül bármelyiket észleli, kérjük tájékoztassa a kezelőorvosát vagy a legközelebbi kórházat.
- Súlyos allergiás reakció (hiperszenzitivitás): a bőr és a nyálkahártya gyors duzzanata a száj és az arc körül (angioödéma). Ezen mellékhatások ritkán alakulnak ki, ritkán súlyos allergiás reakcióhoz vezethetnek, beleértve az anafilaxiás sokkot is.
- Hemofília A-ban szenvedő betegeknél a VIII-as faktort semlegesítő antitestek (inhibitorok) jelenhetnek meg. Ezen inhibitorok jelenléte elégtelen klinikai válaszként jelentkezik. Ilyen esetekben ajánlott egy speciális hemofíliás központtal kapcsolatba lépni.
További mellékhatások
- Egyéb allergiás reakciók (hiperszenzivitás), beleértve:
-- égető és szúró érzés az infúzió beadásának helyén,
-- hidegrázás, kipirulás, a test egészén jelentkező csalánkiütés, kiütések,
-- fejfájás,
-- vérnyomásesés, nyugtalanság, szapora szívdobogás (tahikardia), mellkasi szorító érzés, zihálás,
-- levertség (letargia),
-- hányinger, hányás,
-- zsibbadás.
Ezeket a mellékhatásokat ritkán figyelték meg, azonban egyes esetekben súlyos allergiás reakció (anafilaxia) alakulhat ki, beleértve a sokkot is.
- Lázat is megfigyeltek.
A VIII-as faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
További mellékhatások gyermekeknél
Bár a gyermekpopulációra vonatkozóan nincsenek specifikus adatok, a hatásossági és biztonságossági vizsgálatokkal kapcsolatos néhány közzétett adat nem mutatott jelentős különbséget a felnőttek és az azonos betegségben szenvedő gyermekek között.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik.
A mellékhatásokat közvetlenül a hatóság részére is bejelentheti postai úton az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet Postafiók 450, H-1372 Budapest címre, vagy elektronikusan a www.ogyei.gov.hu honlapon keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
A vírusbiztonsággal kapcsolatos információkat lásd a "2. Tudnivalók a Humaclot alkalmazása előtt" pontban.
5. Hogyan kell a Humaclotot tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és a címkén feltüntetett lejárati idő (Felhasználható:/Felh.:) után ne alkalmazza a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C - 8 °C) tárolandó. Nem fagyasztható!
A fénytől való védelem érdekében az injekciós üveg a külső csomagolásban tárolandó.
Felhasználás előtt ellenőrizze a gyógyszer, a mellékelt fecskendő és a szerelékek csomagolásának sértetlenségét. Csak a sértetlen csomagolású gyógyszert és eszközöket használja fel.
Szobahőmérsékleten (max. +25 °C) a készítmény 6 hónapig tárolható. Ennek megfelelően a felhasználhatóság az eltarthatósági időtartamon belül lejár 6 hónappal azután, hogy a készítményt a hűtőszekrényből először kivették. Ezután az időszak után a készítményt meg kell semmisíteni. Szobahőmérsékleten való tárolás után, a készítmény nem tehető vissza a hűtőszekrénybe.
Az új felhasználhatósági határidőt a külső dobozon fel kell tüntetni. Az elkészített injekciós oldatot csak egyetlen alkalommal szabad felhasználni.
Felbontás után a készítményt azonnal fel kell használni. Az injekciós üveg tartalmát egyszerre kell beadni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Humaclot?
- A készítmény hatóanyaga: liofilizált humán plazma eredetű VIII-as véralvadási faktor.
A Humaclot por és oldószer oldatos injekcióhoz gyógyszerformában az alábbi összetevőket tartalmazza:

Az aktivitást (NE) az Európai Gyógyszerkönyv kromogén vizsgálati módszerével határozzák meg.
A Humaclot fajlagos aktivitása kb. 80 NE/mg fehérje.
Előállítása humán donorok plazmájából történik.
A készítmény Von Willebrand faktort is tartalmaz.
- Egyéb összetevők:
Port tartalmazó injekciós üveg: trinátrium-citrát, nátrium-klorid, glicin, kalcium-klorid
Oldószert tartalmazó injekciós üveg: injekcióhoz való víz.
Milyen a Humaclot külleme és mit tartalmaz a csomagolás?
Por és oldószer oldatos injekcióhoz
A készítményben a feloldást követően előfordulhat néhány pehely vagy részecske. Beadás előtt az oldatot vizuálisan ellenőrizni kell a szilárd részecskék vagy elszíneződés jelenlétét keresve.
A Humaclot oldat tiszta vagy enyhén opálos. Ne használjon olyan oldatot, amely zavaros vagy csapadékos.
Humaclot 500 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: fehér vagy halványsárga színű, higroszkópos por vagy porlékony szilárd anyag.
Oldószert tartalmazó injekciós üveg: színtelen, tiszta, steril folyadék.
Csomagolás
- 1 db port tartalmazó injekciós üveg
- 1 db oldószert tartalmazó injekciós üveg
- 1 db steril áttöltő eszköz szűrővel (Mix2Vial)
- 1 db egyszer használatos fecskendő
- 1 db infúziós kanül
- 2 db alkoholos törlőkendő
- 1 db sebtapasz
Humaclot 1000 NE por és oldószer oldatos injekcióhoz
Port tartalmazó injekciós üveg: fehér vagy halványsárga színű, higroszkópos por vagy porlékony szilárd anyag.
Oldószert tartalmazó injekciós üveg: színtelen, tiszta, steril folyadék.
Csomagolás
- 1 db port tartalmazó injekciós üveg
- 1 db oldószert tartalmazó injekciós üveg
- 1 db steril áttöltő eszköz szűrővel (Mix2Vial)
- 1 db egyszer használatos fecskendő
- 1 db infúziós kanül
- 2 db alkoholos törlőkendő
- 1 db sebtapasz
Fogyasztói ár:
47069Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 47069 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026



















