
HAEMOCTIN 500 NE por és oldószer oldatos injekcióhoz
ATC
VIII koagulációs faktor
Hatóanyag
factor VIII
HAEMOCTIN 500 NE por és oldószer oldatos injekcióhoz betegtájékoztatója
1. Milyen típusú gyógyszer a Haemoctin és milyen betegségek esetén alkalmazható?
A Haemoctin humán plazma eredetű készítmény. A készítmény VIII-as véralvadási faktort tartalmaz, amely a véralvadás élettani folyamatához szükséges. A por injekcióhoz való vízben történő feloldása után az oldat készen áll a vénába való befecskendezésre.
A Haemoctin-t "A" típusú hemofíliában (veleszületett VIII-as faktorhiányban) szenvedők vérzéseinek kezelésére és megelőzésére alkalmazzák.
A Haemoctin nem tartalmaz von Willebrand faktort farmakológiailag hatásos mennyiségben, ezért nem alkalmas a von Willebrand betegség kezelésére.
2. Tudnivalók a Haemoctin alkalmazása előtt
Ne alkalmazza a Haemoctin-t:
- ha allergiás a VIII-as véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére. Az allergiás reakciók közé tartozhat a kiütés, viszketés, légzési nehézség vagy az arc, ajkak, torok, illetve nyelv duzzanata.
Figyelmeztetések és óvintézkedések
Az inhibitorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák, hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben Önnél, illetve gyermekénél a vérzés nem kontrollálható a Haemoctin-nal, azonnal tájékoztassa erről kezelőorvosát.
Ha Önnél már fennállnak szív-érrendszeri (kardiovaszkuláris) kockázati tényezők, a Haemoctin-kezelés fokozhatja a kardiovaszkuláris kockázatot. Ha Ön nem biztos ebben, beszéljen kezelőorvosával.
A katéterrel kapcsolatos szövődmények: Ha szükség van centrális vénás hozzáférést biztosító eszközre, akkor figyelembe kell venni az eszközzel kapcsolatos szövődmények kockázatait, köztük a helyi fertőzéseket, a baktériumok véráramba kerülését (bakterémia) és a katéter bevezetési helyén kialakuló vérrög-képződést (trombózist).
Vírusbiztonság
Emberi vérből vagy plazmából előállított gyógyszerek esetén meghatározott intézkedéseket érvényesítenek, azért, hogy a fertőzések betegekre történő átvitelét megelőzzék. Ezek közé tartozik:
- a vért és plazmát adó donorok gondos kiválasztása, hogy ki lehessen zárni azokat, akiknél fennáll a kórokozók hordozásának kockázata,
- az összes levett anyag egyedi vizsgálata és a plazmakeverékek (poolok) vizsgálata vírus/fertőzések jeleinek kimutatására,
- a plazma feldolgozása során a vírusok inaktiválására, illetve eltávolítására szolgáló eljárási lépések beiktatása.
Mindezen eljárások ellenére az emberi vérből, illetve plazmából előállított gyógyszerek alkalmazása esetén a fertőzések átvitelének lehetősége nem zárható ki teljes mértékben. Ez érvényes az ismeretlen, vagy újonnan felbukkanó vírusokra és egyéb típusú fertőzésekre is.
Az alkalmazott eljárások hatékonynak tekinthetők a burokkal rendelkező vírusokkal, például a humán immundeficiencia vírussal (HIV), a hepatitisz B vírussal (HBV), a hepatitisz C vírussal (HCV), valamint a burokkal nem rendelkező hepatitisz A vírussal szemben.
A burokkal nem rendelkező vírusok, például a parvovírus B19 esetében az eljárások hatékonysága korlátozott lehet. A parvovírus B19 fertőzés veszélyes lehet terhes nők (magzati fertőzés), csökkent immunműködésű betegek számára, valamint olyan betegek esetében, akik bizonyos típusú vérszegénységben szenvednek (pl. sarlósejtes vérszegénység vagy hemolitikus anémia).
Kezelőorvosa javasolhatja, hogy fontolja meg a hepatitisz A és B elleni védőoltást, amennyiben rendszeresen/ismételten humán plazma eredetű VIII-as faktor készítményeket kap.
Minden egyes alkalommal, amikor Haemoctin-t kap, szigorúan ajánlott a készítmény nevének és gyártási számának dokumentálása, hogy a felhasznált tételek gyártási számáról nyilvántartás álljon rendelkezésre.
Gyermekek és serdülők
A felnőttekre vonatkozóan említett figyelmeztetéseket és az alkalmazással kapcsolatos óvintézkedéseket gyermekek és serdülők esetében is figyelembe kell venni.
Egyéb gyógyszerek és a Haemoctin
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
A Haemoctin és egyéb gyógyszerek közötti kölcsönhatásról nem számoltak be.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával.
Mivel az "A" típusú hemofília nőknél ritkán fordul elő, ezért a VIII-as faktor terhesség illetve szoptatás alatt történő alkalmazására vonatkozóan nincs tapasztalat. Vemhes és szoptató állatokkal nem végeztek kísérleteket.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Haemoctin nem, vagy csak elhanyagolható mértékben befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
A Haemoctin nátriumot tartalmaz
Haemoctin 250 NE: injekciós üvegenként legfeljebb 16,1 mg (0,7 mmol) nátriumot (a konyhasó fő összetevője) tartalmaz, ami megfelel az ajánlott maximális napi nátriumbevitel 0,81%-ának felnőtteknél.
Haemoctin 500/1000 NE: injekciós üvegenként legfeljebb 32,2 mg (1,40 mmol) nátriumot (a konyhasó fő összetevője) tartalmaz, ami megfelel az ajánlott maximális napi nátriumbevitel 1,61%-ának felnőtteknél.
3. Hogyan kell alkalmazni a Haemoctin-t?
A Haemoctin intravénás alkalmazásra szolgál (vénába adott injekció). A gyógyszer alkalmazását az "A" típusú hemofília kezelésében jártas orvos felügyelete mellett kell végezni. A Haemoctin-t mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát.
Az adagolás és a kezelés időtartama a VIII-as faktorhiány súlyosságától, a vérzés helyétől és mértékétől, valamint az Ön klinikai állapotától függ. Kezelőorvosa fogja meghatározni az Ön számára megfelelő adagot.
Az alkalmazás minden lépése során biztosítani kell a sterilitást.
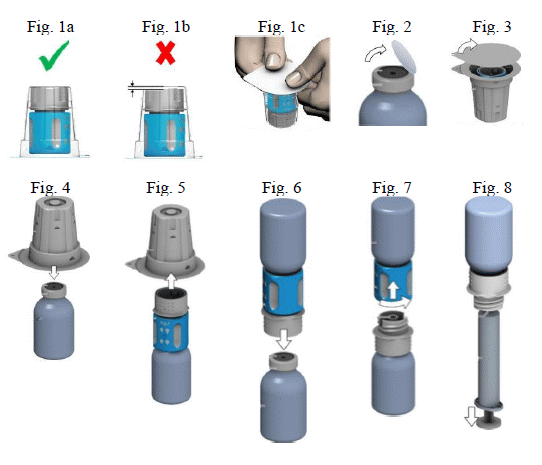
A por feloldása
- A bontatlan injekciós üvegben lévő oldószert (injekcióhoz való vizet) és a port melegítse szobahőmérsékletűre. Ha a melegítés vízfürdőben történik, fokozott figyelmet kell fordítani arra, hogy az injekciós üvegek kupakját és a dugókat ne érje víz. Ellenkező esetben a gyógyszer szennyeződhet.
- Nagyon fontos a transzfer szett megfelelő használatához a felbontás előtt meggyőződni arról, hogy a transzfer szett alsó fehér része közvetlenül a bliszter alján nyugszik (Fig. 1a: helyes, Fig. 1b: helytelen). Ha nem így van, nyomja le a transzfer szettet a bliszterben mindaddig, míg a transzfer szett alsó fehér része közvetlenül a csomagolás aljára nem kerül (Fig. 1c).
- A készítményt és az oldószert tartalmazó injekciós üvegről is távolítsa el a kupakot, hogy a gumidugó közepe hozzáférhető legyen (Fig. 2). Törölje le a készítményt és az oldószert tartalmazó injekciós üvegek gumidugóját fertőtlenítőszerrel.
- Vegye le a transzfer szett csomagolásának tetejét (Fig. 3).
- Helyezze az oldószert tartalmazó injekciós üveget vízszintes felületre. A transzfer szett bliszterben levő kék színű részét tegye a függőleges helyzetben álló, oldószert tartalmazó injekciós üvegre (Fig. 4). Ne forgassa el a transzfer szettet!
- Távolítsa el a transzfer szett bliszterének többi részét is. Ne szorítsa össze a blisztert! Ekkor láthatóvá válik a transzfer szett fehér része (Fig. 5).
- Helyezze a készítményt tartalmazó injekciós üveget vízszintes felületre.
- Fordítsa fejjel lefelé a transzfer szettet és vele együtt az oldószert tartalmazó injekciós üveget. Az adapter fehér részének tüskéjét nyomja át egyenesen lefelé a készítményt tartalmazó injekciós üveg dugóján (Fig. 6). A készítményt tartalmazó injekciós üvegben uralkodó vákuum miatt az oldószer átfolyik a készítményt tartalmazó injekciós üvegbe.
- A készítmény injekciós üvegének óvatos forgatása elősegíti a por feloldódását. Ne rázza erőteljesen, mindenféle hab képződése kerülendő! Az oldat tiszta vagy enyhén opálos.
- Ezt követően csavarja le az óramutató járásával ellentétes irányba a transzfer szett kék részét az oldószert tartalmazó injekciós üveggel együtt (Fig. 7). Dobja ki az oldószert tartalmazó injekciós üveget a transzfer szett kék színű részével együtt. Ekkor láthatóvá válik a Luer-Lock csatlakozó.
Az alkalmazásra kész oldatot a feloldást követően azonnal fel kell használni! A zavaros vagy látható részecskéket tartalmazó oldatot tilos felhasználni.
Az injekció beadása:
- Miután a port a fenti módon feloldotta, csavarja össze a mellékelt fecskendőt a készítményt tartalmazó injekciós üveg Luer-Lock csatlakozójával és a transzfer szett fehér részével (Fig. 8). Ez lehetővé teszi Önnek, hogy a feloldott készítményt (2,5 ml teljes térfogat Haemoctin 250 NE készítmény esetén, 5 ml teljes térfogat Haemoctin 500 NE/1000 NE készítmény esetén) könnyen felszívja a fecskendőbe. Külön szűrő alkalmazása nem szükséges, mivel a transzfer szett saját, beépített szűrővel rendelkezik.
- Óvatosan csavarja le az injekciós üveget és a transzfer szett fehér részét a fecskendőről. A mellékelt szárnyas tű használatával azonnal adja be a gyógyszert, lassan befecskendezve egy vénába. A 2 - 3 ml/perces befecskendezési sebességet nem javasolt túllépni.
- A szárnyas tű a használatot követően a védőkupakkal biztonságossá tehető.
Ha az előírtnál több Haemoctin-t alkalmazott
Ha úgy véli, túl sok Haemoctin-t adtak Önnek, tájékoztassa kezelőorvosát, aki dönt a további kezelésről.
Ha elfelejtette alkalmazni a Haemoctin-t
Ebben az esetben kezelőorvosa eldönti, hogy szükség van-e további kezelésre.
Ha idő előtt abbahagyja a Haemoctin alkalmazását
Ne hagyja abba a Haemoctin alkalmazását anélkül, hogy megbeszélné kezelőorvosával.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Azonnal tájékoztassa kezelőorvosát, amennyiben az alábbi hatások bármelyikét észleli:
- a bőr kivörösödése,
- égő és csípő érzés az injekció helyén,
- hidegrázás,
- kipirulás,
- fejfájás,
- csalánkiütés,
- alacsony vérnyomás,
- súlyos kimerültség (letargia),
- hányinger,
- nyugtalanság,
- szapora szívverés,
- mellkasi szorító érzés,
- fülcsengés,
- hányás,
- sípoló légzés.
Ez allergiás reakció vagy súlyos allergiás reakció (anafilaxiás sokk), illetve túlérzékenységi reakció lehet.
Az alábbi egyéb mellékhatásokat tapasztalták a Haemoctin-nal:
Nem ismert: a rendelkezésre álló adatokból nem állapítható meg
- anafilaxiás sokk (súlyos allergiás reakció), allergiás reakció
- bőr kipirulása, bőrviszketés, csalánkiütés
A VIII-as faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha ez bekövetkezik, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
Mellékhatások gyermekeknél és serdülőknél
Az inhibitorok (antitestek) képződésén kívül a gyermekeknél jelentkező mellékhatások várhatóan megegyeznek a felnőtteknél tapasztaltakkal.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül:
Nemzeti Népegészségügyi és Gyógyszerészeti Központ, Postafiók 450, H-1372 Budapest
honlap: https://ogyei.gov.hu
elektronikus bejelentő form: https://mellekhatas.ogyei.gov.hu/
e-mail: adr.box@nngyk.gov.hu
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Haemoctin-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A fénytől való védelem érdekében az injekciós üvegeket tartsa a dobozban.
Legfeljebb 25 °C-on tárolandó. Nem fagyasztható!
Az injekciós üveg címkéjén és a dobozon feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza a Haemoctin-t.
Bármilyen fel nem használt gyógyszer, illetve hulladékanyag megsemmisítését a gyógyszerekre vonatkozó előírások szerint kell végrehajtani. Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Haemoctin?
- A készítmény hatóanyaga a humán VIII-as véralvadási faktor.
- Egyéb összetevők: glicin, nátrium-klorid, nátrium-citrát, kalcium-klorid.
- Az oldószert tartalmazó injekciós üveg injekcióhoz való vizet tartalmaz.
Milyen a Haemoctin külleme és mit tartalmaz a csomagolás?
A Haemoctin fagyasztva szárított (liofilizált) por formájában kapható. Az injekcióhoz való víz oldószerként szolgál. A feloldott készítmény áttetsző vagy enyhén opálos.
A Haemoctin 250 NE 1 db 250 NE port tartalmazó injekciós üveg, valamint 1 db, 2,5 ml (100 NE/ml) injekcióhoz való vizet tartalmazó injekciós üveg.
A Haemoctin 500 NE 1 db 500 NE port tartalmazó injekciós üveg, valamint 1 db, 5 ml (100 NE/ml) injekcióhoz való vizet tartalmazó injekciós üveg.
A Haemoctin 1000 NE 1 db 1000 NE port tartalmazó injekciós üveg, valamint 1 db, 5 ml (200 NE/ml) injekcióhoz való vizet tartalmazó injekciós üveg.
Mindegyik csomagolás tartalma:
- 1 db egyszer használatos fecskendő,
- 1 db, beépített szűrőt tartalmazó transzfer szett,
- 1 db szárnyas tű.
A Haemoctin humán plazma eredetű készítmény. A készítmény VIII-as véralvadási faktort tartalmaz, amely a véralvadás élettani folyamatához szükséges. A por injekcióhoz való vízben történő feloldása után az oldat készen áll a vénába való befecskendezésre.
A Haemoctin-t "A" típusú hemofíliában (veleszületett VIII-as faktorhiányban) szenvedők vérzéseinek kezelésére és megelőzésére alkalmazzák.
A Haemoctin nem tartalmaz von Willebrand faktort farmakológiailag hatásos mennyiségben, ezért nem alkalmas a von Willebrand betegség kezelésére.
2. Tudnivalók a Haemoctin alkalmazása előtt
Ne alkalmazza a Haemoctin-t:
- ha allergiás a VIII-as véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére. Az allergiás reakciók közé tartozhat a kiütés, viszketés, légzési nehézség vagy az arc, ajkak, torok, illetve nyelv duzzanata.
Figyelmeztetések és óvintézkedések
Az inhibitorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák, hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben Önnél, illetve gyermekénél a vérzés nem kontrollálható a Haemoctin-nal, azonnal tájékoztassa erről kezelőorvosát.
Ha Önnél már fennállnak szív-érrendszeri (kardiovaszkuláris) kockázati tényezők, a Haemoctin-kezelés fokozhatja a kardiovaszkuláris kockázatot. Ha Ön nem biztos ebben, beszéljen kezelőorvosával.
A katéterrel kapcsolatos szövődmények: Ha szükség van centrális vénás hozzáférést biztosító eszközre, akkor figyelembe kell venni az eszközzel kapcsolatos szövődmények kockázatait, köztük a helyi fertőzéseket, a baktériumok véráramba kerülését (bakterémia) és a katéter bevezetési helyén kialakuló vérrög-képződést (trombózist).
Vírusbiztonság
Emberi vérből vagy plazmából előállított gyógyszerek esetén meghatározott intézkedéseket érvényesítenek, azért, hogy a fertőzések betegekre történő átvitelét megelőzzék. Ezek közé tartozik:
- a vért és plazmát adó donorok gondos kiválasztása, hogy ki lehessen zárni azokat, akiknél fennáll a kórokozók hordozásának kockázata,
- az összes levett anyag egyedi vizsgálata és a plazmakeverékek (poolok) vizsgálata vírus/fertőzések jeleinek kimutatására,
- a plazma feldolgozása során a vírusok inaktiválására, illetve eltávolítására szolgáló eljárási lépések beiktatása.
Mindezen eljárások ellenére az emberi vérből, illetve plazmából előállított gyógyszerek alkalmazása esetén a fertőzések átvitelének lehetősége nem zárható ki teljes mértékben. Ez érvényes az ismeretlen, vagy újonnan felbukkanó vírusokra és egyéb típusú fertőzésekre is.
Az alkalmazott eljárások hatékonynak tekinthetők a burokkal rendelkező vírusokkal, például a humán immundeficiencia vírussal (HIV), a hepatitisz B vírussal (HBV), a hepatitisz C vírussal (HCV), valamint a burokkal nem rendelkező hepatitisz A vírussal szemben.
A burokkal nem rendelkező vírusok, például a parvovírus B19 esetében az eljárások hatékonysága korlátozott lehet. A parvovírus B19 fertőzés veszélyes lehet terhes nők (magzati fertőzés), csökkent immunműködésű betegek számára, valamint olyan betegek esetében, akik bizonyos típusú vérszegénységben szenvednek (pl. sarlósejtes vérszegénység vagy hemolitikus anémia).
Kezelőorvosa javasolhatja, hogy fontolja meg a hepatitisz A és B elleni védőoltást, amennyiben rendszeresen/ismételten humán plazma eredetű VIII-as faktor készítményeket kap.
Minden egyes alkalommal, amikor Haemoctin-t kap, szigorúan ajánlott a készítmény nevének és gyártási számának dokumentálása, hogy a felhasznált tételek gyártási számáról nyilvántartás álljon rendelkezésre.
Gyermekek és serdülők
A felnőttekre vonatkozóan említett figyelmeztetéseket és az alkalmazással kapcsolatos óvintézkedéseket gyermekek és serdülők esetében is figyelembe kell venni.
Egyéb gyógyszerek és a Haemoctin
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
A Haemoctin és egyéb gyógyszerek közötti kölcsönhatásról nem számoltak be.
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával.
Mivel az "A" típusú hemofília nőknél ritkán fordul elő, ezért a VIII-as faktor terhesség illetve szoptatás alatt történő alkalmazására vonatkozóan nincs tapasztalat. Vemhes és szoptató állatokkal nem végeztek kísérleteket.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Haemoctin nem, vagy csak elhanyagolható mértékben befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
A Haemoctin nátriumot tartalmaz
Haemoctin 250 NE: injekciós üvegenként legfeljebb 16,1 mg (0,7 mmol) nátriumot (a konyhasó fő összetevője) tartalmaz, ami megfelel az ajánlott maximális napi nátriumbevitel 0,81%-ának felnőtteknél.
Haemoctin 500/1000 NE: injekciós üvegenként legfeljebb 32,2 mg (1,40 mmol) nátriumot (a konyhasó fő összetevője) tartalmaz, ami megfelel az ajánlott maximális napi nátriumbevitel 1,61%-ának felnőtteknél.
3. Hogyan kell alkalmazni a Haemoctin-t?
A Haemoctin intravénás alkalmazásra szolgál (vénába adott injekció). A gyógyszer alkalmazását az "A" típusú hemofília kezelésében jártas orvos felügyelete mellett kell végezni. A Haemoctin-t mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát.
Az adagolás és a kezelés időtartama a VIII-as faktorhiány súlyosságától, a vérzés helyétől és mértékétől, valamint az Ön klinikai állapotától függ. Kezelőorvosa fogja meghatározni az Ön számára megfelelő adagot.
Az alkalmazás minden lépése során biztosítani kell a sterilitást.

A por feloldása
- A bontatlan injekciós üvegben lévő oldószert (injekcióhoz való vizet) és a port melegítse szobahőmérsékletűre. Ha a melegítés vízfürdőben történik, fokozott figyelmet kell fordítani arra, hogy az injekciós üvegek kupakját és a dugókat ne érje víz. Ellenkező esetben a gyógyszer szennyeződhet.
- Nagyon fontos a transzfer szett megfelelő használatához a felbontás előtt meggyőződni arról, hogy a transzfer szett alsó fehér része közvetlenül a bliszter alján nyugszik (Fig. 1a: helyes, Fig. 1b: helytelen). Ha nem így van, nyomja le a transzfer szettet a bliszterben mindaddig, míg a transzfer szett alsó fehér része közvetlenül a csomagolás aljára nem kerül (Fig. 1c).
- A készítményt és az oldószert tartalmazó injekciós üvegről is távolítsa el a kupakot, hogy a gumidugó közepe hozzáférhető legyen (Fig. 2). Törölje le a készítményt és az oldószert tartalmazó injekciós üvegek gumidugóját fertőtlenítőszerrel.
- Vegye le a transzfer szett csomagolásának tetejét (Fig. 3).
- Helyezze az oldószert tartalmazó injekciós üveget vízszintes felületre. A transzfer szett bliszterben levő kék színű részét tegye a függőleges helyzetben álló, oldószert tartalmazó injekciós üvegre (Fig. 4). Ne forgassa el a transzfer szettet!
- Távolítsa el a transzfer szett bliszterének többi részét is. Ne szorítsa össze a blisztert! Ekkor láthatóvá válik a transzfer szett fehér része (Fig. 5).
- Helyezze a készítményt tartalmazó injekciós üveget vízszintes felületre.
- Fordítsa fejjel lefelé a transzfer szettet és vele együtt az oldószert tartalmazó injekciós üveget. Az adapter fehér részének tüskéjét nyomja át egyenesen lefelé a készítményt tartalmazó injekciós üveg dugóján (Fig. 6). A készítményt tartalmazó injekciós üvegben uralkodó vákuum miatt az oldószer átfolyik a készítményt tartalmazó injekciós üvegbe.
- A készítmény injekciós üvegének óvatos forgatása elősegíti a por feloldódását. Ne rázza erőteljesen, mindenféle hab képződése kerülendő! Az oldat tiszta vagy enyhén opálos.
- Ezt követően csavarja le az óramutató járásával ellentétes irányba a transzfer szett kék részét az oldószert tartalmazó injekciós üveggel együtt (Fig. 7). Dobja ki az oldószert tartalmazó injekciós üveget a transzfer szett kék színű részével együtt. Ekkor láthatóvá válik a Luer-Lock csatlakozó.
Az alkalmazásra kész oldatot a feloldást követően azonnal fel kell használni! A zavaros vagy látható részecskéket tartalmazó oldatot tilos felhasználni.
Az injekció beadása:
- Miután a port a fenti módon feloldotta, csavarja össze a mellékelt fecskendőt a készítményt tartalmazó injekciós üveg Luer-Lock csatlakozójával és a transzfer szett fehér részével (Fig. 8). Ez lehetővé teszi Önnek, hogy a feloldott készítményt (2,5 ml teljes térfogat Haemoctin 250 NE készítmény esetén, 5 ml teljes térfogat Haemoctin 500 NE/1000 NE készítmény esetén) könnyen felszívja a fecskendőbe. Külön szűrő alkalmazása nem szükséges, mivel a transzfer szett saját, beépített szűrővel rendelkezik.
- Óvatosan csavarja le az injekciós üveget és a transzfer szett fehér részét a fecskendőről. A mellékelt szárnyas tű használatával azonnal adja be a gyógyszert, lassan befecskendezve egy vénába. A 2 - 3 ml/perces befecskendezési sebességet nem javasolt túllépni.
- A szárnyas tű a használatot követően a védőkupakkal biztonságossá tehető.
Ha az előírtnál több Haemoctin-t alkalmazott
Ha úgy véli, túl sok Haemoctin-t adtak Önnek, tájékoztassa kezelőorvosát, aki dönt a további kezelésről.
Ha elfelejtette alkalmazni a Haemoctin-t
Ebben az esetben kezelőorvosa eldönti, hogy szükség van-e további kezelésre.
Ha idő előtt abbahagyja a Haemoctin alkalmazását
Ne hagyja abba a Haemoctin alkalmazását anélkül, hogy megbeszélné kezelőorvosával.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Azonnal tájékoztassa kezelőorvosát, amennyiben az alábbi hatások bármelyikét észleli:
- a bőr kivörösödése,
- égő és csípő érzés az injekció helyén,
- hidegrázás,
- kipirulás,
- fejfájás,
- csalánkiütés,
- alacsony vérnyomás,
- súlyos kimerültség (letargia),
- hányinger,
- nyugtalanság,
- szapora szívverés,
- mellkasi szorító érzés,
- fülcsengés,
- hányás,
- sípoló légzés.
Ez allergiás reakció vagy súlyos allergiás reakció (anafilaxiás sokk), illetve túlérzékenységi reakció lehet.
Az alábbi egyéb mellékhatásokat tapasztalták a Haemoctin-nal:
Nem ismert: a rendelkezésre álló adatokból nem állapítható meg
- anafilaxiás sokk (súlyos allergiás reakció), allergiás reakció
- bőr kipirulása, bőrviszketés, csalánkiütés
A VIII-as faktor tartalmú gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1-nél) kialakulhatnak inhibitor ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakori (100 beteg közül kevesebb mint 1 beteget érinthet) gyakorisággal jelentkezik. Ha ez bekövetkezik, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
Mellékhatások gyermekeknél és serdülőknél
Az inhibitorok (antitestek) képződésén kívül a gyermekeknél jelentkező mellékhatások várhatóan megegyeznek a felnőtteknél tapasztaltakkal.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül:
Nemzeti Népegészségügyi és Gyógyszerészeti Központ, Postafiók 450, H-1372 Budapest
honlap: https://ogyei.gov.hu
elektronikus bejelentő form: https://mellekhatas.ogyei.gov.hu/
e-mail: adr.box@nngyk.gov.hu
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Haemoctin-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A fénytől való védelem érdekében az injekciós üvegeket tartsa a dobozban.
Legfeljebb 25 °C-on tárolandó. Nem fagyasztható!
Az injekciós üveg címkéjén és a dobozon feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza a Haemoctin-t.
Bármilyen fel nem használt gyógyszer, illetve hulladékanyag megsemmisítését a gyógyszerekre vonatkozó előírások szerint kell végrehajtani. Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Haemoctin?
- A készítmény hatóanyaga a humán VIII-as véralvadási faktor.
- Egyéb összetevők: glicin, nátrium-klorid, nátrium-citrát, kalcium-klorid.
- Az oldószert tartalmazó injekciós üveg injekcióhoz való vizet tartalmaz.
Milyen a Haemoctin külleme és mit tartalmaz a csomagolás?
A Haemoctin fagyasztva szárított (liofilizált) por formájában kapható. Az injekcióhoz való víz oldószerként szolgál. A feloldott készítmény áttetsző vagy enyhén opálos.
A Haemoctin 250 NE 1 db 250 NE port tartalmazó injekciós üveg, valamint 1 db, 2,5 ml (100 NE/ml) injekcióhoz való vizet tartalmazó injekciós üveg.
A Haemoctin 500 NE 1 db 500 NE port tartalmazó injekciós üveg, valamint 1 db, 5 ml (100 NE/ml) injekcióhoz való vizet tartalmazó injekciós üveg.
A Haemoctin 1000 NE 1 db 1000 NE port tartalmazó injekciós üveg, valamint 1 db, 5 ml (200 NE/ml) injekcióhoz való vizet tartalmazó injekciós üveg.
Mindegyik csomagolás tartalma:
- 1 db egyszer használatos fecskendő,
- 1 db, beépített szűrőt tartalmazó transzfer szett,
- 1 db szárnyas tű.
Fogyasztói ár:
77774Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 77774 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026


















