
MIRCERA 100 µg/0,3 ml oldatos injekció előretöltött fecskendőben
ATC
Methoxy polyethylene glycol-epoetin beta
Hatóanyag
epoetin beta
MIRCERA 100 µg/0,3 ml oldatos injekció előretöltött fecskendőben betegtájékoztatója
1. Milyen típusú gyógyszer a MIRCERA és milyen betegségek esetén alkalmazható?
Ezt a gyógyszert vérszegénységének kezelésére írták fel Önnek, melyet krónikus vesebetegsége okoz és olyan jellemző tünetekkel jár, mint a fáradtság, gyengeség és légszomj. Ez azt jelenti, hogy az Ön vörösvértest-száma nagyon kevés és hemoglobinszintje nagyon alacsony (testének szövetei ezért nem kapnak elég oxigént).
A MIRCERA kizárólag a krónikus vesebetegség talaján kialakult, tünetekkel együttjáró vérszegénység kezelésére javallott. Használata felnőtt betegekre korlátozódik (18 évesek vagy annál idősebbek).
A MIRCERA géntechnológiával előállított gyógyszer. A természetes eritropoetin hormonhoz hasonlóan, a MIRCERA növeli vérében a vörösvértestek számát és a hemoglobinszintet.
2. Tudnivalók a MIRCERA alkalmazása előtt
Ne alkalmazza a MIRCERA-t
- ha allergiás a béta-epoetin metoxi-polietilénglikol vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
- ha magas vérnyomás betegségét nem tudják megfelelően kezelni.
Figyelmeztetések és óvintézkedések
A MIRCERA-kezelés biztonságosságát és hatásosságát más indikációkban, beleértve a daganatos betegek vérszegénységét, nem bizonyították.
A MIRCERA-kezelés megkezdése előtt
- A vérképzést serkentő gyógyszerekkel, köztük a MIRCERA-val kezelt néhány betegnél tiszta vörösvértest apláziának nevezett betegséget (PRCA, a vörösvértestek képződésének csökkenésével vagy hiányával járó betegség) figyeltek meg, melyet az eritropoetin ellen képződő ellenanyagok okoznak.
- Amennyiben kezelőorvosa úgy gondolja, vagy igazoltnak látja, hogy az Ön vérében ilyen ellenanyagok keringenek, Ön semmiképpen sem kaphat MIRCERA-kezelést.
- Ha Ön hepatitisz C betegségben szenved, és interferont, illetve ribavirint kap, beszélje meg ezt kezelőorvosával, mivel ritka esetekben az eritropoezist serkentő gyógyszerekkel együtt adott interferon és ribavirin a hatás csökkenését okozta, és PRCA kialakulásához vezetett, amely a vérszegénység egyik súlyos formája. Az eritropoezist serkentő gyógyszerek alkalmazása a hepatitisz C-vel összefüggő vérszegénység kezelésére nem engedélyezett.
- Ha Ön krónikus vesebetegségben szenved, vérszegénységének kezelésére eritropoezist serkentő gyógyszert kap és daganatos betegsége is van, tudnia kell, hogy az eritropoezist serkentő gyógyszerek kedvezőtlenül befolyásolhatják az állapotát. Beszélje meg kezelőorvosával a vérszegénység kezelésének lehetőségeit.
- Nem ismert, hogy a MIRCERA hatása megváltozik-e hemoglobinopátiákban (rendellenességek, melyekben kóros hemoglobinok mutathatók ki), korábbi vagy jelenleg is fennálló vérzés esetén, görcsökkel járó megbetegedésekben vagy magas vérlemezkeszám esetében. Amennyiben bármelyik előfordul, kezelőorvosa megbeszéli Önnel állapotát, és körültekintően kell, hogy kezelje Önt.
- Egészséges embereket nem szabad MIRCERA-val kezelni. Ha mégis megtörténne, a hemoglobinszint túl magasra emelkedhet, és az életet veszélyeztető szív- és érrendszeri betegségek léphetnek fel.
MIRCERA-kezelés alatt
- Ha Ön krónikus veseelégtelenségben szenved, és különösen, ha Ön nem megfelelően reagál a MIRCERA-ra, kezelőorvosa ellenőrizni fogja az Ön MIRCERA adagját, mivel a MIRCERA adagok nem megfelelő válasz esetén történő ismételt emelése fokozhatja a szívvel vagy vérerekkel kapcsolatos problémák kialakulásának veszélyét és növelheti a szívinfarktus, az agyvérzés és a halál bekövetkeztének kockázatát.
- A kezelőorvos elkezdheti a MIRCERA kezelést, ha az Ön hemoglobin értéke 10 g/dl (6,21 mmol/l), vagy kevesebb. Ezután a kezelőorvos úgy fogja Önt kezelni, hogy a hemoglobin értéke 10 és 12 g/dl (7,45 mmol/l) között maradjon.
- A MIRCERA-kezelés előtt és a kezelés során kezelőorvosa ellenőrizni fogja vére vastartalmát.
Ha a vas mennyisége túl kevés, a kezelőorvos vaspótlást adhat Önnek.
- A MIRCERA-kezelés előtt és a kezelés folyamán kezelőorvosa ellenőrizni fogja az Ön vérnyomását. Ha vérnyomása magas, és nem állítható be a megfelelő gyógyszerekkel vagy speciális diétával, kezelőorvosa megszakítja a MIRCERA-kezelést, vagy csökkenti a gyógyszere adagját.
- Kezelőorvosa ellenőrizni fogja, hogy a hemoglobin szintje nem lép-e túl egy bizonyos értéket, amelyen felül növekedhet a szív-, és érrendszeri betegségek és ezáltal a trombózis, beleértve a tüdőembólia, szívinfarktus, agyvérzés és a halálos kimenetelű esetek kialakulásának kockázata.
- Keresse fel kezelőorvosát ha fáradtnak, gyöngének érzi magát vagy légszomja van, mert ez a MIRCERA-kezelés hatástalanságát jelezheti Önnél. A kezelőorvos megvizsgálja majd, és előfordulhat, hogy a vérszegénység egyéb okainak kizárása céljából vérvizsgálatokat vagy csontvelővizsgálatot végeztet. Ha Önnél PRCA fejlődött ki, abba fogják hagyni a MIRCERA- kezelést. Másik vérképzést serkentő gyógyszeres kezelést sem fog kapni, és kezelőorvosa kezelni fogja kialakult betegségét.
Gyermekek és serdülők
Gyermekek és serdülők számára a MIRCERA-kezelés nem ajánlott, mert ezeken a betegeken a MIRCERA-t nem vizsgálták.
Egyéb gyógyszerek, amelyek serkentik a vörösvértestek termelődését, fokozott elővigyázatossággal alkalmazhatók: A MIRCERA a gyógyszerek egy olyan csoportjába tartozik, amelyek úgy serkentik a vörösvértestek termelődését, mint az emberi eritropoetin nevű fehérje. Az Önt kezelő orvos mindig fel fogja jegyezni, hogy pontosan milyen gyógyszert használ.
Az epoetin kezeléssel összefüggésbe hozható súlyos bőrreakciókat, köztük Stevens-Johnson szindrómát (SJS) és toxikus epidermális nekrolízis (TEN) eseteit jelentették.
A SJS/TEN kezdetben a törzsön vöröses célpont-szerű pöttyökként vagy köralakú, gyakran a közepén hólyagos foltokként jelentkezhet. Úgyszintén előfordulhatnak fekélyek a szájnyálkahártyán, a torokban, az orrban, a nemi szerveken és a szemeken (vörös és duzzadt szemek). Ezeket a súlyos bőrkiütéseket gyakran láz és/vagy influenzaszerű tünetek előzik meg. A kiütések súlyosbodása a bőr kiterjedt területen való hámlásához és életveszélyes komplikációkhoz is vezethet.
Ha Ön súlyos bőrkiütést vagy a fenti bőrtünetek valamelyikét tapasztalja, hagyja abba a MIRCERA alkalmazását és azonnal keresse fel a kezelőorvosát vagy forduljon orvoshoz.
Egyéb gyógyszerek és a MIRCERA
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg, vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
Gyógyszerkölcsönhatás vizsgálatokat nem végeztek. Nincs bizonyíték arra, hogy a MIRCERA más gyógyszerekkel kölcsönhatásba lép.
A MIRCERA egyidejű alkalmazása étellel és itallal
Étel és ital nem befolyásolja a MIRCERA hatását.
Terhesség, szoptatás és termékenység
Mielőtt bármilyen gyógyszert elkezdene szedni, beszélje meg kezelőorvosával vagy gyógyszerészével.
A MIRCERA-t nem vizsgálták terhes vagy szoptató nőknél.
Mondja el kezelőorvosának, ha terhes, ha úgy gondolja, hogy terhes, vagy ha gyermeket tervez. A kezelőorvos mérlegelni fogja, mi a legmegfelelőbb kezelés az Ön számára terhessége alatt.
Mondja el kezelőorvosának ha szoptat, vagy szoptatni akar. A kezelőorvos javaslatot fog adni Önnek, hogy abbahagyja-e a szoptatást vagy sem, illetve hogy abba kell-e hagynia vagy folytathatja-e a gyógyszeres kezelést.
Állatoknál nem bizonyították, hogy a MIRCERA a termékenység károsodását okozza. Az emberekre vonatkozó lehetséges kockázat nem ismert.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A MIRCERA nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
Fontos információ a MIRCERA egyes összetevőiről
A készítmény kevesebb mint 1 millimól (23 mg) nátriumot tartalmaz milliliterenként, azaz gyakorlatilag nátriummentes.
3. Hogyan kell alkalmazni a MIRCERA-t?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Kezelőorvosa az anémia tüneteinek kezeléséhez a legalacsonyabb hatásos adagot fogja alkalmazni.
Ha Ön nem megfelelően reagál a MIRCERA-ra, kezelőorvosa ellenőrizni fogja az Ön adagját és tájékoztatja arról, hogy szükséges-e a MIRCERA adagjának módosítása.
A MIRCERA-kezelést csak szakorvos felügyelete alatt lehet elkezdeni.
A további injekciókat beadhatja képzett ápolónő vagy orvos, és miután megtanították Önnek a beadás módját (lásd a betegtájékoztató végén), beadhatja saját magának is.
A MIRCERA beadható a has, a kar vagy a comb bőre alá vagy vénába. Kezelőorvosa dönti el, hogy az Ön számára melyik a legmegfelelőbb.
Kezelőorvosa rendszeresen vérvizsgálatot fog végeztetni, melynek során a hemoglobinszint mérésével ellenőrzi majd, hogyan reagál vérszegénysége a kezelésre.
- Ha Önt eddig még nem kezelték eritropoezist serkentő gyógyszerrel
-- Amennyiben Ön nem részesül művesekezelésben, a MIRCERA ajánlott kezdő adagja 1,2 mikrogramm testsúlykilogrammonként, amit havonta egyszer, a bőr alá adott egyetlen injekció formájában kell beadni. Alternatívaként, a kezelőorvosa dönthet úgy is, hogy a kezdő adag 0,6 mikrogramm testsúlykilogrammonként. Az adagot kéthetente egyszer, a bőr alá vagy vénába adott egyetlen injekció formájában kell beadni. Ha vérszegénysége rendeződőtt, kezelőorvosa a havi egyszeri adagolásra is áttérhet.
-- Amennyiben Ön művesekezelésben részesül, az ajánlott kezdő adag 0,6 mikrogramm testsúlykilogrammonként. Az adagot kéthetente egyszer, a bőr alá vagy vénába adott egyetlen injekció formájában kell beadni. Ha vérszegénysége rendeződőtt, kezelőorvosa a havi egyszeri adagolásra is áttérhet.
Kezelőorvosa az Önnek megfelelő hemoglobinszint elérése érdekében emelheti, illetve csökkentheti az adagot, vagy átmenetileg felfüggesztheti a kezelést. Az adag egy hónapban csak egyszer változtatható.
- Ha Önt jelenleg más, eritropoezist serkentő gyógyszerrel kezelik
Kezelőorvosa kicserélheti a jelenlegi gyógyszerét MIRCERA-ra, amit Önnek egyetlen injekció formájában, havonta egyszer kell beadni. A MIRCERA kezdő adagját kezelőorvosa az eddig alkalmazott gyógyszer utolsó adagja alapján számítja ki. Az első MIRCERA adagot az előző gyógyszer tervezett beadási napján kapja majd meg.
Kezelőrvosa emelheti vagy csökkentheti az adagot, vagy időnként leállíthatja a kezelést, hogy az Ön számára megfelelő hemoglobinértéket be tudja állítani. Az adagot havonta egynél többször nem fogja módosítani.
Ha az előírtnál több MIRCERA-t alkalmazott
Kérjük forduljon kezelőorvosához vagy gyógyszerészéhez, ha túl nagy MIRCERA adagot adott be, mert előfordulhat, hogy vérvizsgálatot kell végezni, és kezelését meg kell szakítani.
Ha elfelejtette alkalmazni a MIRCERA-t
Ha elfelejtett egy adagot beadni, adja be amint eszébe jut, és beszélje meg kezelőorvosával, mikor adhatja be a következő adagot.
Ha idő előtt abbahagyja a MIRCERA alkalmazását
A MIRCERA-kezelés általában hosszútávú, azonban ha kezelőorvosa úgy ítéli meg, a kezelés bármikor megszakítható.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A lehetséges mellékhatásokat a következő gyakorisági kategóriákba sorolták be:
Gyakori mellékhatás (10 beteg közül legfeljebb 1 betegnél fordulhat elő) a hipertenzió (magas vérnyomás).
Nem-gyakori mellékhatások (100 beteg közül legfeljebb 1 betegnél fordulhat elő):
- fejfájás.
- értrombózis (vérrög a művesekezeléshez kialakított erekben)
- alacsony vérlemezkeszám (trombocitopénia).
- trombózis
Ritka mellékhatások (1000 beteg közül legfeljebb 1 betegnél fordulhat elő):
- hipertóniás enkefalopátia (nagyon magas vérnyomás mely fejfájást okozhat, különösen hirtelen, szúró, migrén-szerű fejfájás, zavartság, beszédzavar, görcsök és rángógörcsök léphetnek fel).
- tüdőembólia
- makulo-papuláris bőrkiütés (piros bőrreakció, mely pattanások vagy foltok formájában jelentkezik).
- hőhullám.
- túlérzékenységi reakció (allergiás reakció, mely szokatlan sípoló- vagy nehézlégzést okozhat; felduzzad a nyelv, arc vagy torok, vagy duzzanat keletkezik az injekció beadásának helyén, vagy szédülés, gyengeség érzés, ájulás következik be).
Ha ilyen tünetek jelentkeznek, azonnal forduljon orvoshoz, hogy megkapja a szükséges kezelést.
A klinikai vizsgálatok során a betegek vérlemezkeszáma enyhén csökkent. A forgalomba hozatalt követően jelentették a vérlemezkeszámnak a normális érték alá történő csökkenését (trombocitopénia).
Spontán jelentettek túlérzékenységi reakciókat, köztük anafilaxiás reakciókat és az epoetin kezeléssel összefüggésbe hozható súlyos bőrreakciókat, köztük Stevens-Johnson szindrómát (SJS) és toxikus epidermális nekrolízis eseteit jelentették. Ezek kezdetben a törzsön vöröses célpont-szerű pöttyökként vagy köralakú, gyakran a közepén hólyagos foltokként jelentkezhetnek, vagy bőrhámlás, illetve fekélyekként a szájnyálkahártyán, a torokban, az orrban, a nemi szerveken és a szemeken, és gyakran láz és influenzaszerű tünetek előzhetik meg. Ha Önnél ezek a tünetek jelentkeznek, hagyja abba a MIRCERA alkalmazását és azonnal keresse fel a kezelőorvosát vagy forduljon orvoshoz. Olvassa el a 2. pontot is.
Az eritropoezist serkentő más gyógyszerekhez hasonlóan trombózisos eseteket, köztük tüdőembóliát jelentettek a forgalomba hozatalt követően.
A vérképzést serkentő gyógyszerekkel, köztük a MIRCERA-val kezelt néhány betegnél tiszta vörösvértest apláziának nevezett betegséget (PRCA, a vörösvértestek képződésének csökkenésével vagy hiányával járó betegség) figyeltek meg, melyet az eritropoetin ellen képződő ellenanyagok okoznak.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a MIRCERA-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és az előretöltött fecskendőn feltüntetett lejárati idő (Exp:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C-8 °C) tárolandó. Nem fagyasztható!
A fénytől való védelem érdekében az előretöltött fecskendő az eredeti csomagolásban tárolandó. A MIRCERA előretöltött fecskendőt egyszer ki lehet venni a hűtőszekrényből és egy hónapig szobahőmérsékleten tartani, legfeljebb 30 °C-on. Ezalatt az idő alatt, amikor a MIRCERA-t szobahőmérsékleten, legfeljebb 30 °C-on tárolta, felhasználás előtt ne tegye vissza a hűtőszekrénybe.
Ha egyszer már kivette a gyógyszert a hűtőszekrényből, azt egy hónapon belül fel kell használnia.
Kízárólag az az oldat adható be, amely tiszta, színtelen vagy enyhén sárgás színű és látható részecskéktől mentes.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a MIRCERA
- A készítmény hatóanyaga béta-epoetin metoxi-polietilénglikol. Egy előretöltött fecskendő tartalmaz:
30, 40, 50, 60, 75, 100, 120, 150, 200 vagy 250 mikrogrammot 0,3 ml-ben és
360 mikrogrammot 0,6 ml-ben.
- Egyéb összetevő(k): nátrium-dihidrogén-foszfát-monohidrát, nátrium-szulfát, mannit (E421), metionin, poloxamer 188, injekcióhoz való víz.
Milyen a MIRCERA külleme és mit tartalmaz a csomagolás
A MIRCERA oldatos injekció előretöltött fecskendőben.
Az oldat tiszta, színtelen vagy enyhén sárgás, és látható részecskéktől mentes.
A MIRCERA előretöltött fecskendő laminált tolórúddal és lepattintható kupakkal ellátott 27G1/2-es injekciós tűvel kerül forgalomba. Egy előretöltött fecskendőben 0,3 vagy 0,6 ml oldat van. A MIRCERA minden hatáserőssége egyszeres csomagolásban, valamint a 30, 50, 75 mikrogramm/0,3 ml-es hatáserősség háromszoros csomagolásban is elérhető. Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
MIRCERA előretöltött fecskendő
Használati utasítás

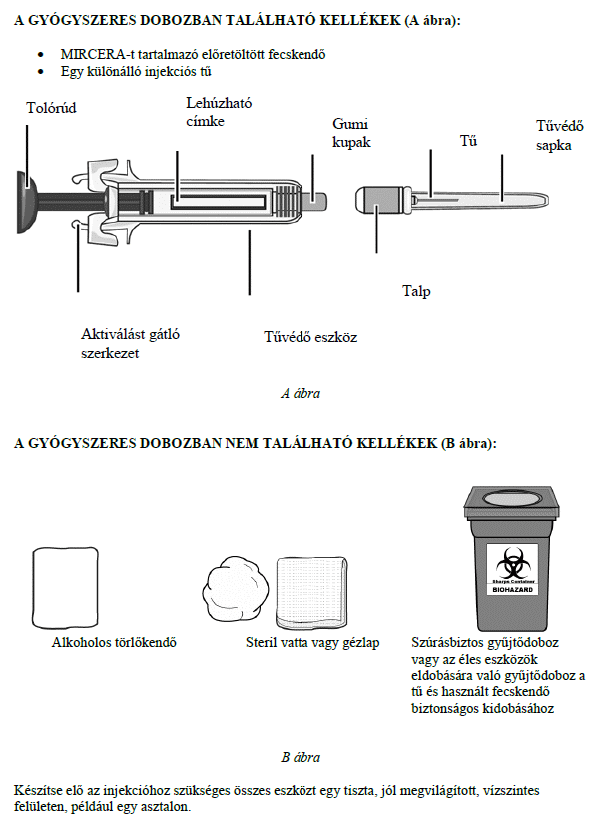
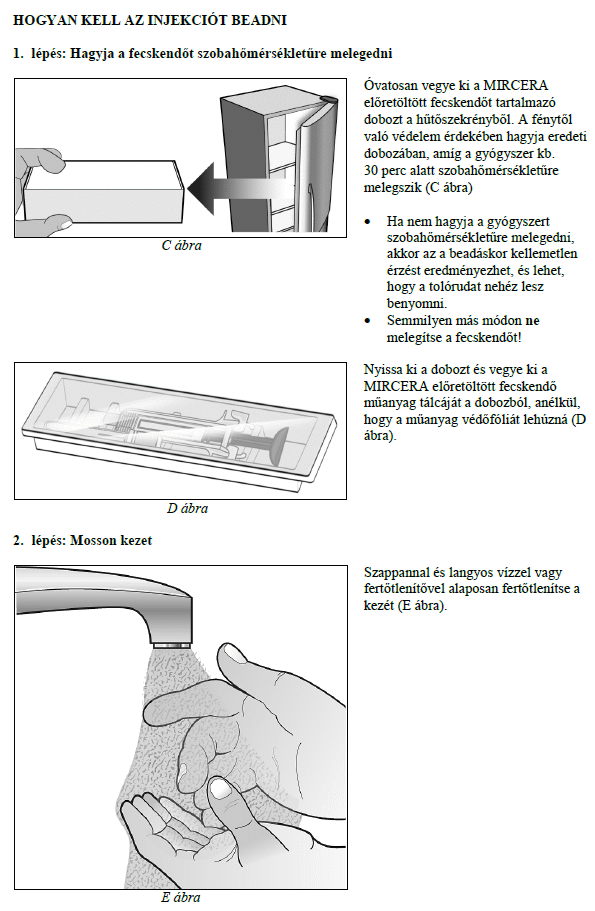
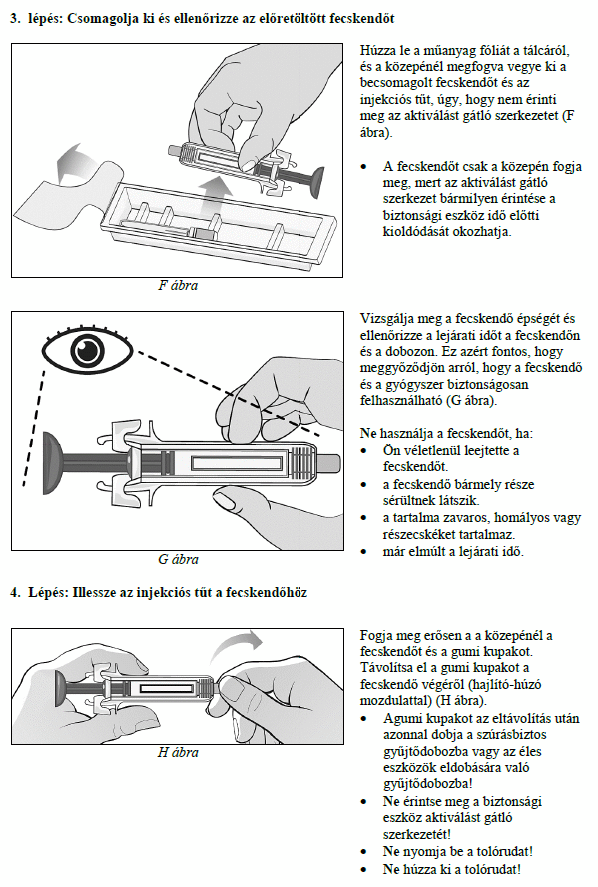
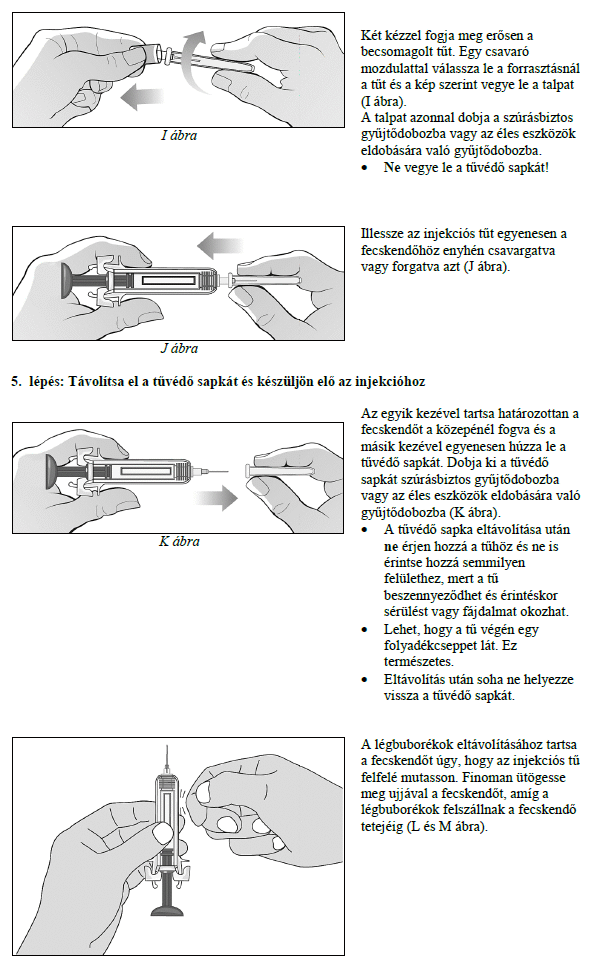
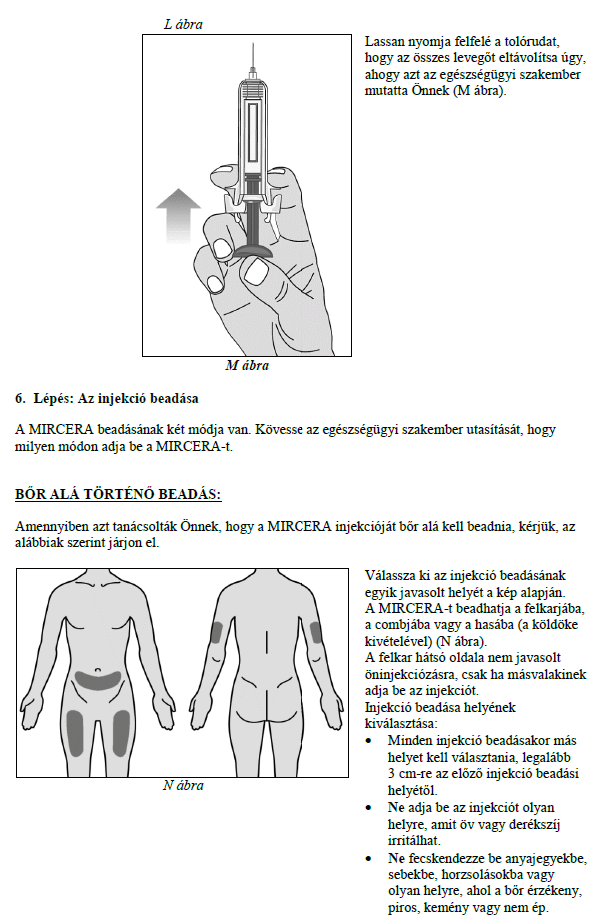
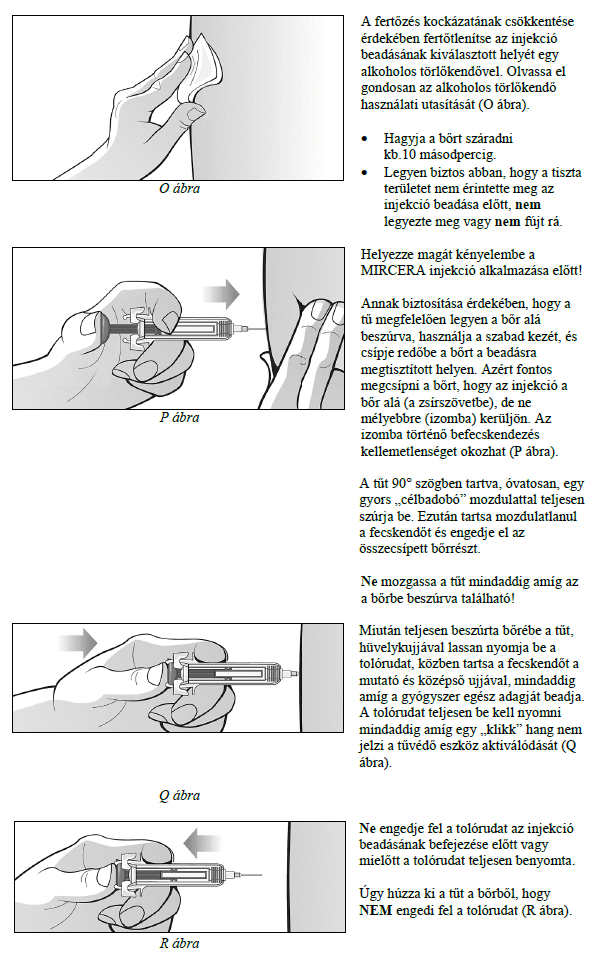
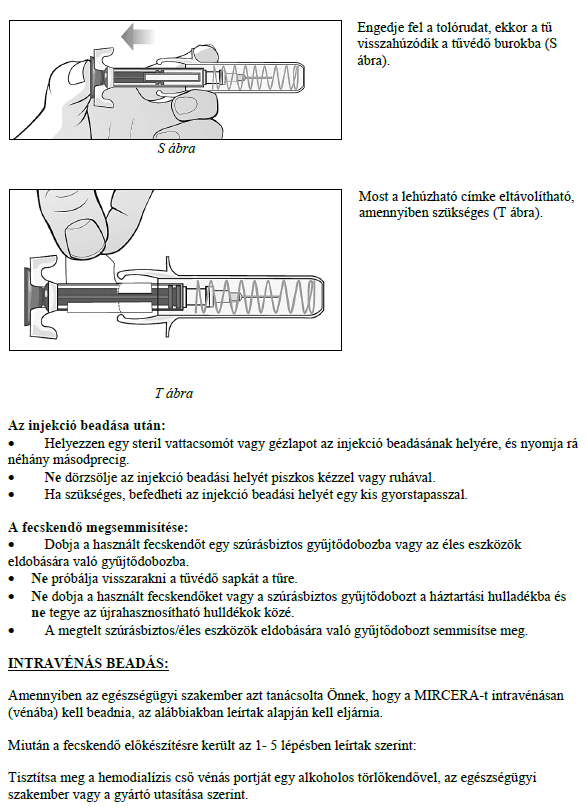
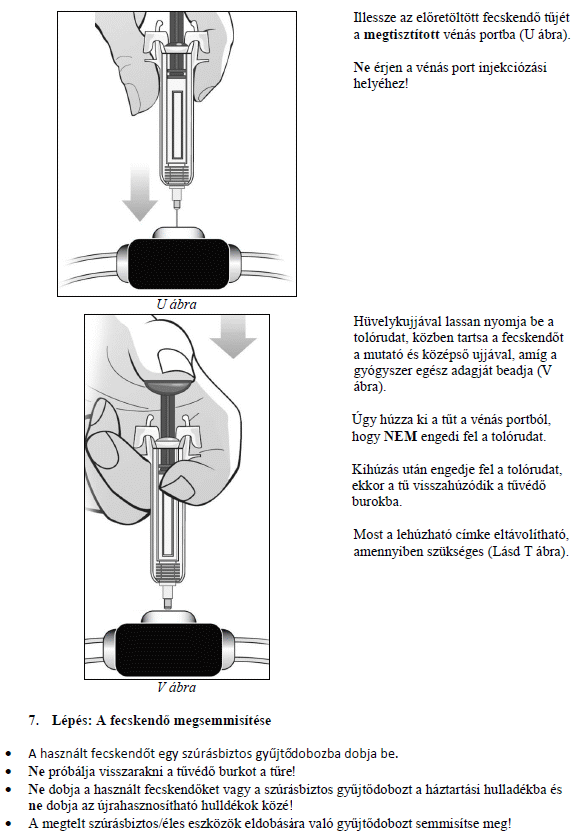
Ezt a gyógyszert vérszegénységének kezelésére írták fel Önnek, melyet krónikus vesebetegsége okoz és olyan jellemző tünetekkel jár, mint a fáradtság, gyengeség és légszomj. Ez azt jelenti, hogy az Ön vörösvértest-száma nagyon kevés és hemoglobinszintje nagyon alacsony (testének szövetei ezért nem kapnak elég oxigént).
A MIRCERA kizárólag a krónikus vesebetegség talaján kialakult, tünetekkel együttjáró vérszegénység kezelésére javallott. Használata felnőtt betegekre korlátozódik (18 évesek vagy annál idősebbek).
A MIRCERA géntechnológiával előállított gyógyszer. A természetes eritropoetin hormonhoz hasonlóan, a MIRCERA növeli vérében a vörösvértestek számát és a hemoglobinszintet.
2. Tudnivalók a MIRCERA alkalmazása előtt
Ne alkalmazza a MIRCERA-t
- ha allergiás a béta-epoetin metoxi-polietilénglikol vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
- ha magas vérnyomás betegségét nem tudják megfelelően kezelni.
Figyelmeztetések és óvintézkedések
A MIRCERA-kezelés biztonságosságát és hatásosságát más indikációkban, beleértve a daganatos betegek vérszegénységét, nem bizonyították.
A MIRCERA-kezelés megkezdése előtt
- A vérképzést serkentő gyógyszerekkel, köztük a MIRCERA-val kezelt néhány betegnél tiszta vörösvértest apláziának nevezett betegséget (PRCA, a vörösvértestek képződésének csökkenésével vagy hiányával járó betegség) figyeltek meg, melyet az eritropoetin ellen képződő ellenanyagok okoznak.
- Amennyiben kezelőorvosa úgy gondolja, vagy igazoltnak látja, hogy az Ön vérében ilyen ellenanyagok keringenek, Ön semmiképpen sem kaphat MIRCERA-kezelést.
- Ha Ön hepatitisz C betegségben szenved, és interferont, illetve ribavirint kap, beszélje meg ezt kezelőorvosával, mivel ritka esetekben az eritropoezist serkentő gyógyszerekkel együtt adott interferon és ribavirin a hatás csökkenését okozta, és PRCA kialakulásához vezetett, amely a vérszegénység egyik súlyos formája. Az eritropoezist serkentő gyógyszerek alkalmazása a hepatitisz C-vel összefüggő vérszegénység kezelésére nem engedélyezett.
- Ha Ön krónikus vesebetegségben szenved, vérszegénységének kezelésére eritropoezist serkentő gyógyszert kap és daganatos betegsége is van, tudnia kell, hogy az eritropoezist serkentő gyógyszerek kedvezőtlenül befolyásolhatják az állapotát. Beszélje meg kezelőorvosával a vérszegénység kezelésének lehetőségeit.
- Nem ismert, hogy a MIRCERA hatása megváltozik-e hemoglobinopátiákban (rendellenességek, melyekben kóros hemoglobinok mutathatók ki), korábbi vagy jelenleg is fennálló vérzés esetén, görcsökkel járó megbetegedésekben vagy magas vérlemezkeszám esetében. Amennyiben bármelyik előfordul, kezelőorvosa megbeszéli Önnel állapotát, és körültekintően kell, hogy kezelje Önt.
- Egészséges embereket nem szabad MIRCERA-val kezelni. Ha mégis megtörténne, a hemoglobinszint túl magasra emelkedhet, és az életet veszélyeztető szív- és érrendszeri betegségek léphetnek fel.
MIRCERA-kezelés alatt
- Ha Ön krónikus veseelégtelenségben szenved, és különösen, ha Ön nem megfelelően reagál a MIRCERA-ra, kezelőorvosa ellenőrizni fogja az Ön MIRCERA adagját, mivel a MIRCERA adagok nem megfelelő válasz esetén történő ismételt emelése fokozhatja a szívvel vagy vérerekkel kapcsolatos problémák kialakulásának veszélyét és növelheti a szívinfarktus, az agyvérzés és a halál bekövetkeztének kockázatát.
- A kezelőorvos elkezdheti a MIRCERA kezelést, ha az Ön hemoglobin értéke 10 g/dl (6,21 mmol/l), vagy kevesebb. Ezután a kezelőorvos úgy fogja Önt kezelni, hogy a hemoglobin értéke 10 és 12 g/dl (7,45 mmol/l) között maradjon.
- A MIRCERA-kezelés előtt és a kezelés során kezelőorvosa ellenőrizni fogja vére vastartalmát.
Ha a vas mennyisége túl kevés, a kezelőorvos vaspótlást adhat Önnek.
- A MIRCERA-kezelés előtt és a kezelés folyamán kezelőorvosa ellenőrizni fogja az Ön vérnyomását. Ha vérnyomása magas, és nem állítható be a megfelelő gyógyszerekkel vagy speciális diétával, kezelőorvosa megszakítja a MIRCERA-kezelést, vagy csökkenti a gyógyszere adagját.
- Kezelőorvosa ellenőrizni fogja, hogy a hemoglobin szintje nem lép-e túl egy bizonyos értéket, amelyen felül növekedhet a szív-, és érrendszeri betegségek és ezáltal a trombózis, beleértve a tüdőembólia, szívinfarktus, agyvérzés és a halálos kimenetelű esetek kialakulásának kockázata.
- Keresse fel kezelőorvosát ha fáradtnak, gyöngének érzi magát vagy légszomja van, mert ez a MIRCERA-kezelés hatástalanságát jelezheti Önnél. A kezelőorvos megvizsgálja majd, és előfordulhat, hogy a vérszegénység egyéb okainak kizárása céljából vérvizsgálatokat vagy csontvelővizsgálatot végeztet. Ha Önnél PRCA fejlődött ki, abba fogják hagyni a MIRCERA- kezelést. Másik vérképzést serkentő gyógyszeres kezelést sem fog kapni, és kezelőorvosa kezelni fogja kialakult betegségét.
Gyermekek és serdülők
Gyermekek és serdülők számára a MIRCERA-kezelés nem ajánlott, mert ezeken a betegeken a MIRCERA-t nem vizsgálták.
Egyéb gyógyszerek, amelyek serkentik a vörösvértestek termelődését, fokozott elővigyázatossággal alkalmazhatók: A MIRCERA a gyógyszerek egy olyan csoportjába tartozik, amelyek úgy serkentik a vörösvértestek termelődését, mint az emberi eritropoetin nevű fehérje. Az Önt kezelő orvos mindig fel fogja jegyezni, hogy pontosan milyen gyógyszert használ.
Az epoetin kezeléssel összefüggésbe hozható súlyos bőrreakciókat, köztük Stevens-Johnson szindrómát (SJS) és toxikus epidermális nekrolízis (TEN) eseteit jelentették.
A SJS/TEN kezdetben a törzsön vöröses célpont-szerű pöttyökként vagy köralakú, gyakran a közepén hólyagos foltokként jelentkezhet. Úgyszintén előfordulhatnak fekélyek a szájnyálkahártyán, a torokban, az orrban, a nemi szerveken és a szemeken (vörös és duzzadt szemek). Ezeket a súlyos bőrkiütéseket gyakran láz és/vagy influenzaszerű tünetek előzik meg. A kiütések súlyosbodása a bőr kiterjedt területen való hámlásához és életveszélyes komplikációkhoz is vezethet.
Ha Ön súlyos bőrkiütést vagy a fenti bőrtünetek valamelyikét tapasztalja, hagyja abba a MIRCERA alkalmazását és azonnal keresse fel a kezelőorvosát vagy forduljon orvoshoz.
Egyéb gyógyszerek és a MIRCERA
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg, vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
Gyógyszerkölcsönhatás vizsgálatokat nem végeztek. Nincs bizonyíték arra, hogy a MIRCERA más gyógyszerekkel kölcsönhatásba lép.
A MIRCERA egyidejű alkalmazása étellel és itallal
Étel és ital nem befolyásolja a MIRCERA hatását.
Terhesség, szoptatás és termékenység
Mielőtt bármilyen gyógyszert elkezdene szedni, beszélje meg kezelőorvosával vagy gyógyszerészével.
A MIRCERA-t nem vizsgálták terhes vagy szoptató nőknél.
Mondja el kezelőorvosának, ha terhes, ha úgy gondolja, hogy terhes, vagy ha gyermeket tervez. A kezelőorvos mérlegelni fogja, mi a legmegfelelőbb kezelés az Ön számára terhessége alatt.
Mondja el kezelőorvosának ha szoptat, vagy szoptatni akar. A kezelőorvos javaslatot fog adni Önnek, hogy abbahagyja-e a szoptatást vagy sem, illetve hogy abba kell-e hagynia vagy folytathatja-e a gyógyszeres kezelést.
Állatoknál nem bizonyították, hogy a MIRCERA a termékenység károsodását okozza. Az emberekre vonatkozó lehetséges kockázat nem ismert.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A MIRCERA nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
Fontos információ a MIRCERA egyes összetevőiről
A készítmény kevesebb mint 1 millimól (23 mg) nátriumot tartalmaz milliliterenként, azaz gyakorlatilag nátriummentes.
3. Hogyan kell alkalmazni a MIRCERA-t?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Kezelőorvosa az anémia tüneteinek kezeléséhez a legalacsonyabb hatásos adagot fogja alkalmazni.
Ha Ön nem megfelelően reagál a MIRCERA-ra, kezelőorvosa ellenőrizni fogja az Ön adagját és tájékoztatja arról, hogy szükséges-e a MIRCERA adagjának módosítása.
A MIRCERA-kezelést csak szakorvos felügyelete alatt lehet elkezdeni.
A további injekciókat beadhatja képzett ápolónő vagy orvos, és miután megtanították Önnek a beadás módját (lásd a betegtájékoztató végén), beadhatja saját magának is.
A MIRCERA beadható a has, a kar vagy a comb bőre alá vagy vénába. Kezelőorvosa dönti el, hogy az Ön számára melyik a legmegfelelőbb.
Kezelőorvosa rendszeresen vérvizsgálatot fog végeztetni, melynek során a hemoglobinszint mérésével ellenőrzi majd, hogyan reagál vérszegénysége a kezelésre.
- Ha Önt eddig még nem kezelték eritropoezist serkentő gyógyszerrel
-- Amennyiben Ön nem részesül művesekezelésben, a MIRCERA ajánlott kezdő adagja 1,2 mikrogramm testsúlykilogrammonként, amit havonta egyszer, a bőr alá adott egyetlen injekció formájában kell beadni. Alternatívaként, a kezelőorvosa dönthet úgy is, hogy a kezdő adag 0,6 mikrogramm testsúlykilogrammonként. Az adagot kéthetente egyszer, a bőr alá vagy vénába adott egyetlen injekció formájában kell beadni. Ha vérszegénysége rendeződőtt, kezelőorvosa a havi egyszeri adagolásra is áttérhet.
-- Amennyiben Ön művesekezelésben részesül, az ajánlott kezdő adag 0,6 mikrogramm testsúlykilogrammonként. Az adagot kéthetente egyszer, a bőr alá vagy vénába adott egyetlen injekció formájában kell beadni. Ha vérszegénysége rendeződőtt, kezelőorvosa a havi egyszeri adagolásra is áttérhet.
Kezelőorvosa az Önnek megfelelő hemoglobinszint elérése érdekében emelheti, illetve csökkentheti az adagot, vagy átmenetileg felfüggesztheti a kezelést. Az adag egy hónapban csak egyszer változtatható.
- Ha Önt jelenleg más, eritropoezist serkentő gyógyszerrel kezelik
Kezelőorvosa kicserélheti a jelenlegi gyógyszerét MIRCERA-ra, amit Önnek egyetlen injekció formájában, havonta egyszer kell beadni. A MIRCERA kezdő adagját kezelőorvosa az eddig alkalmazott gyógyszer utolsó adagja alapján számítja ki. Az első MIRCERA adagot az előző gyógyszer tervezett beadási napján kapja majd meg.
Kezelőrvosa emelheti vagy csökkentheti az adagot, vagy időnként leállíthatja a kezelést, hogy az Ön számára megfelelő hemoglobinértéket be tudja állítani. Az adagot havonta egynél többször nem fogja módosítani.
Ha az előírtnál több MIRCERA-t alkalmazott
Kérjük forduljon kezelőorvosához vagy gyógyszerészéhez, ha túl nagy MIRCERA adagot adott be, mert előfordulhat, hogy vérvizsgálatot kell végezni, és kezelését meg kell szakítani.
Ha elfelejtette alkalmazni a MIRCERA-t
Ha elfelejtett egy adagot beadni, adja be amint eszébe jut, és beszélje meg kezelőorvosával, mikor adhatja be a következő adagot.
Ha idő előtt abbahagyja a MIRCERA alkalmazását
A MIRCERA-kezelés általában hosszútávú, azonban ha kezelőorvosa úgy ítéli meg, a kezelés bármikor megszakítható.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A lehetséges mellékhatásokat a következő gyakorisági kategóriákba sorolták be:
Gyakori mellékhatás (10 beteg közül legfeljebb 1 betegnél fordulhat elő) a hipertenzió (magas vérnyomás).
Nem-gyakori mellékhatások (100 beteg közül legfeljebb 1 betegnél fordulhat elő):
- fejfájás.
- értrombózis (vérrög a művesekezeléshez kialakított erekben)
- alacsony vérlemezkeszám (trombocitopénia).
- trombózis
Ritka mellékhatások (1000 beteg közül legfeljebb 1 betegnél fordulhat elő):
- hipertóniás enkefalopátia (nagyon magas vérnyomás mely fejfájást okozhat, különösen hirtelen, szúró, migrén-szerű fejfájás, zavartság, beszédzavar, görcsök és rángógörcsök léphetnek fel).
- tüdőembólia
- makulo-papuláris bőrkiütés (piros bőrreakció, mely pattanások vagy foltok formájában jelentkezik).
- hőhullám.
- túlérzékenységi reakció (allergiás reakció, mely szokatlan sípoló- vagy nehézlégzést okozhat; felduzzad a nyelv, arc vagy torok, vagy duzzanat keletkezik az injekció beadásának helyén, vagy szédülés, gyengeség érzés, ájulás következik be).
Ha ilyen tünetek jelentkeznek, azonnal forduljon orvoshoz, hogy megkapja a szükséges kezelést.
A klinikai vizsgálatok során a betegek vérlemezkeszáma enyhén csökkent. A forgalomba hozatalt követően jelentették a vérlemezkeszámnak a normális érték alá történő csökkenését (trombocitopénia).
Spontán jelentettek túlérzékenységi reakciókat, köztük anafilaxiás reakciókat és az epoetin kezeléssel összefüggésbe hozható súlyos bőrreakciókat, köztük Stevens-Johnson szindrómát (SJS) és toxikus epidermális nekrolízis eseteit jelentették. Ezek kezdetben a törzsön vöröses célpont-szerű pöttyökként vagy köralakú, gyakran a közepén hólyagos foltokként jelentkezhetnek, vagy bőrhámlás, illetve fekélyekként a szájnyálkahártyán, a torokban, az orrban, a nemi szerveken és a szemeken, és gyakran láz és influenzaszerű tünetek előzhetik meg. Ha Önnél ezek a tünetek jelentkeznek, hagyja abba a MIRCERA alkalmazását és azonnal keresse fel a kezelőorvosát vagy forduljon orvoshoz. Olvassa el a 2. pontot is.
Az eritropoezist serkentő más gyógyszerekhez hasonlóan trombózisos eseteket, köztük tüdőembóliát jelentettek a forgalomba hozatalt követően.
A vérképzést serkentő gyógyszerekkel, köztük a MIRCERA-val kezelt néhány betegnél tiszta vörösvértest apláziának nevezett betegséget (PRCA, a vörösvértestek képződésének csökkenésével vagy hiányával járó betegség) figyeltek meg, melyet az eritropoetin ellen képződő ellenanyagok okoznak.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a MIRCERA-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és az előretöltött fecskendőn feltüntetett lejárati idő (Exp:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C-8 °C) tárolandó. Nem fagyasztható!
A fénytől való védelem érdekében az előretöltött fecskendő az eredeti csomagolásban tárolandó. A MIRCERA előretöltött fecskendőt egyszer ki lehet venni a hűtőszekrényből és egy hónapig szobahőmérsékleten tartani, legfeljebb 30 °C-on. Ezalatt az idő alatt, amikor a MIRCERA-t szobahőmérsékleten, legfeljebb 30 °C-on tárolta, felhasználás előtt ne tegye vissza a hűtőszekrénybe.
Ha egyszer már kivette a gyógyszert a hűtőszekrényből, azt egy hónapon belül fel kell használnia.
Kízárólag az az oldat adható be, amely tiszta, színtelen vagy enyhén sárgás színű és látható részecskéktől mentes.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a MIRCERA
- A készítmény hatóanyaga béta-epoetin metoxi-polietilénglikol. Egy előretöltött fecskendő tartalmaz:
30, 40, 50, 60, 75, 100, 120, 150, 200 vagy 250 mikrogrammot 0,3 ml-ben és
360 mikrogrammot 0,6 ml-ben.
- Egyéb összetevő(k): nátrium-dihidrogén-foszfát-monohidrát, nátrium-szulfát, mannit (E421), metionin, poloxamer 188, injekcióhoz való víz.
Milyen a MIRCERA külleme és mit tartalmaz a csomagolás
A MIRCERA oldatos injekció előretöltött fecskendőben.
Az oldat tiszta, színtelen vagy enyhén sárgás, és látható részecskéktől mentes.
A MIRCERA előretöltött fecskendő laminált tolórúddal és lepattintható kupakkal ellátott 27G1/2-es injekciós tűvel kerül forgalomba. Egy előretöltött fecskendőben 0,3 vagy 0,6 ml oldat van. A MIRCERA minden hatáserőssége egyszeres csomagolásban, valamint a 30, 50, 75 mikrogramm/0,3 ml-es hatáserősség háromszoros csomagolásban is elérhető. Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
MIRCERA előretöltött fecskendő
Használati utasítás









Fogyasztói ár:
64707Ft
A feltüntetett ár tájékoztató jellegű, patikánként kisebb-nagyobb eltérés előfordulhat.
Normatív támogatás esetén téritési díj: 64707 Ft
 Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026
Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja. © Vidal Next Kft. 2026



















